Autores: Sánchez Álvarez, Luis Omar, López Cordero, Zaydi, Huayllani Ramírez, Kathy, Gonzales Rivera, Gilmer, Agurto Medina, Katia

Tomado de: MegaWebs.cl 2018
- Minerales: composición porcentual y pureza
1.1 Composición porcentual
Es el porcentaje en masa de cada elemento presente en un compuesto, para su cálculo se deben seguir los siguientes pasos. Primer paso, se tiene que hallar la masar molar del compuesto. Segundo paso, es multiplicar el número de moles de uno de los compuestos por la masa molar de este. Tercer paso, se debe dividir lo obtenido en el segundo paso entre lo obtenido en el primer paso y por último se tiene que multiplicar por cien (2013:75-117).
Todos estos pasos se pueden resumir en la siguiente fórmula:
n = número de moles del elemento
1.2 Grado de pureza de un mineral
La ley se refiere al grado de pureza en que se encuentra la especie mineral en la roca de un yacimiento. La ley de cobre expresa el porcentaje de cobre que encierra una determinada muestra. Cuando se habla de una ley del 1% significa que en cada 100 kilogramos de roca mineralizada hay 1 kilogramo de cobre puro.
Se denomina grado de pureza al porcentaje que tiene una muestra dada de una determinada sustancia (2013:75-117).
A continuación se mencionan algunos ejemplos de determinación de pureza:
El oro
La cianuración es una técnica metalúrgica para obtener oro de mineral de baja calidad, se tiene el siguiente proceso electroquímico
4 Au(s) + 8 NaCN(s) + O2(g) + 2 H2O(l) → 4 Na[Au(CN)2](s) + 4 NaOH(ac)
Calcular:
- La composición porcentual del oro, Au, en el dicianoaurato de sodio, Na[Au(CN)2]
- La pureza de Au de una muestra de 200 g de dicianoaurato de sodio, Na[Au(CN)2]
Solución:
El hierro
La pirita es un mineral cuyo componente mayoritario es el sulfuro de hierro (II). Su tostación de lugar al trióxido de dihierro y dióxido de azufre, de acuerdo con la reacción
4FeS(s) + 7O2 (g) → 2Fe2O3(s) + 4SO2(g)
Calcular:
- La composición porcentual del hierro, Fe, en el trióxido de dihierro, Fe2O3(s)
- La pureza de Fe si después de la tostación se produjo 20g de Fe2O3(s),
El zinc
En un recipiente se tiene una muestra de 60 g de una roca mineral triturada que contiene zincita o cincita que es la forma mineral del óxido de zinc, ZnO, esta muestra pasa por un proceso de tamizado donde se obtiene 40 gramos de zincita, calcular:
- La composición porcentual del Zn en el la zincita, ZnO.
- La pureza del Zn después del proceso de tamizado.
Plata
| Argentita | Ag2S |
| Estefanita | Ag5SbS4 |
En un recipiente se tiene una muestra de 70g de una roca mineral triturada que contiene Argentita (Ag2S). Esta pasa por un proceso en el cual se obtiene 35g de Argentita, calcular:
- La composición porcentual de Ag en la Argentita,Ag2S.
- La pureza de Ag en la muestra dada.
Cobre
| Calcocita | Cu2S |
| Calcopirita | CuFeS2 |
En un recipiente se tiene una muestra de 60g de una roca mineral que contiene Calcopirita (CuFeS2). Esta pasa por un proceso en el cual se obtiene 42g de Calcopirita, calcular:
- La composición porcentual de Cu en la, CuFeS2.
- La pureza de Cu en la muestra dada.
Plomo
| Galena | PbS |
| Mimetita | Pb5(AsO4)3Cl |
En un recipiente se tiene una muestra de 80g de una roca mineral que contiene Mimetita (Pb5(AsO4)3Cl). Esta pasa por un proceso físico en el cual se obtiene 30g de Mimetita, calcular:
- La composición porcentual de Pb en la Mimetita, Pb5(AsO4)3
- La pureza de Cu luego del proceso.
- Refinamiento pirometalúrgico y electrometalúrgico de metales
¿En qué consiste el refinado de metales? Consiste en la eliminación de impurezas del metal ya que, la materia prima al ser extraída presenta entre un 96 o 98% de metal puro y el resto es de impureza. Por esta razón, el elemento se refina para estar más purificado. Además, los metales se usan para formar aleaciones para mejorar sus propiedades.
Existen dos métodos comunes de refinación entre ellos está el pirometalúrgico y electrometalúrgico de metales. Estos métodos se basan en las diferentes propiedades de cada elemento por ejemplo la temperatura de fusión, la densidad y electronegatividad. Después de varias etapas de refinación, se obtiene los metales puros. (Proto.2014)
2.1 Refinación pirometalurgica:
La refinación pirometalúrgica se encarga de obtener la purificación de los metales, a través de la utilización del calor, es decir, a altas temperaturas en una masa fundida, que son producidas por la quema de distintos combustibles. Este método es utilizado en gran proporción ya que es un proceso que se desarrolla en menor tiempo, pero también posee desventajas como ser un contaminante para el medio ambiente debido a los residuos gaseosos como el SO2. (Proto: 2014)
La mayoría de los metales como hierro, cobre, níquel, oro y otros fueron extraídos de los minerales a través de esta técnica eliminando la ganga que se trata de los silicatos o de minerales sin interés. Este método abarca diferentes procesos como la calcinación, tostación y reducción. (Muñoz: 3-5)
TOSTACION: Es una fase que consiste en el calentamiento de los minerales en presencia del oxígeno del aire transformándose en un oxido de metal o dióxido de azufre en estado gaseoso. Luego dicho gas puede ser usado para la fabricación del ácido sulfúrico y de esa manera se evita la contaminación del medio ambiente y la formación de la lluvia acida (Muñoz: 3-5).
Los hornos de tostación donde se lleva a cabo este proceso son de diferentes formas como la tostación oxidante, magnetizante, reductora, segregante entre otras. (Muñoz: 3-5)
Ejemplo:
La tostación de sulfuros de cinc y de plomo, se realiza a través de las siguientes reacciones: (Méndez: 2010)
2ZnS (s) + 3 O2 (g) → 2 ZnO (s) + 2 SO2 (g)
2PbS (s) + 3 O2 (g) → 2 PbO (s) + 2 SO2 (g)
El mercurio se obtiene directamente en forma de vapor a partir del sulfuro, condensándose dicho vapor y pasando a estado líquido (Méndez: 2010)
HgS (s) + O2 (g) → SO2 (g) + Hg (g)
CALCINACION: Los minerales que contienen hidróxidos son calentados a una temperatura muy alta, con la finalidad de que el mineral se descomponga y de esa manera eliminar el gas: vapor de agua y dióxido de carbono. Así se obtiene el óxido del metal, por ejemplo. (Méndez: 2010)
2 Fe (OH)3 (s) → Fe2O3 (s) + 3 H2O (g)
ZnCO3 (s) → ZnO (s) + CO2 (g)
DESTILACION: esta fase consiste en la obtención del metal libre en el cual el metal aparece con oxidación positiva. El punto de ebullición de los metales y de las impurezas es diferente, por esta razón, se realiza repetidamente volatilización y condensación para separarlos. Esta técnica tiene como objetivo eliminar el Cd del Zn o el Zn del Pb y la separación del Al, Mg y Ti en la metalurgia. La filtración del metal líquido se realiza en filtros de cerámica eliminando las impurezas sólidas (Proto: 2014).
2.2 Refinacion electrometalurgica
Ciencia que consiste en el estudio del tratamiento de los metales promedio en base de la electricidad. Muchos procesos se basan en la electrólisis los cuales están ligados a la electroquímica que abarca la relación entre electricidad y reacciones químicas dando lugar a las celdas electrolíticas y a las pilas galvánicas (2130: 815-861)
Electrólisis
Es una técnica de purificación. Al momento de tostar el sulfuro de cobre se obtiene cobre metálico que aún contiene impurezas como zinc, hierro, plata y oro. Mediante un proceso electrolítico se eliminan los metales más electropositivos, donde el cobre impuro cumple el rol de ánodo y el cobre puro como cátodo, en una disolución de ácido sulfúrico que contiene iones Cu+2. En el ánodo de cobre, los metales reactivos como el hierro y el zinc, se oxidan y pasan a la disolución en forma de Fe2+ y Zn2+, pero no se reducen en el cátodo. Los metales menos electropositivos como el oro y la plata no se oxidan y caen al fondo de la celda formando el llamado “lodo anódico” de donde serán recuperados posteriormente. El resultado neto del proceso electrolítico es la transferencia del cobre desde el ánodo hacia el cátodo, resultando un cobre con una pureza superior a 99.5% (2013:815-861)
Purificación electrolítica del cobre (Tomado de Chem, Josep, 2011)
- La reactividad de metales
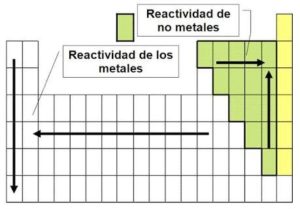
La reactividad de un elemento es la tendencia de este a combinarse con otros, en la mayoría de los casos estos se encuentran formando compuestos. En un periodo, la reactividad de los metales aumenta cuanto más a la izquierda en el período (menos electrones a quitar). Además, la reactividad de los metales aumenta al avanzar en el grupo (mayor tendencia a perder electrones) (Ecured 2018).
Reactividad (Tomado de ECURED, 2018)
- Metales alcalinos
Debido a su gran reactividad química, los metales alcalinos nunca se encuentran en la naturaleza en su forma elemental, se localizan combinados con iones halogenados, sulfato, carbonato y silicato (2013:944-947).
Por ejemplo, formación del peróxido.
2 K(s) + ½ O2(g) → K2O(s)
- Metales alcalinotérreos
Estos metales son menos reactivos que los alcalinos. A excepción del primer miembro de esta familia: Berilio. (2013:948-950).
Bibliografía
CHANG, Raymond y GOLDSBY, Kenneth
2013 Química. Undécima edición. New York: McGraw Hill Education.
ECURED
Reactividad. Consulta: 07 de junio de 2018
https://www.ecured.cu/Reactividad#Reactividad_de_metales_y_no_metales
MÉNDEZ, Ángeles
2010 “Pirometalurgia”. La guía. Consulta: 02 de junio del 2018.
https://quimica.laguia2000.com/reacciones-quimicas/pirometalurgia
MUÑOZ, María José
“Extracción de metales por pirometalurgia: Procesamiento de hierro, acero, cobre y aluminio”. Consulta: 02 de junio del 2018.
PROTO
2014 “Economía Circular y Minería Urbana”. Minería urbana. Consulta: 02 de junio del 2018.
https://mineriaurbana.org/2014/03/03/refinacion-de-metales/comment-page-1/
MATERIAL COMPLEMENTARIO SUGERIDO POR LA PROFESORA
Tema Metales y minerales – Brown