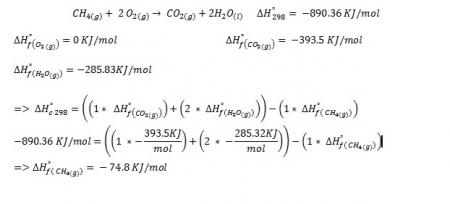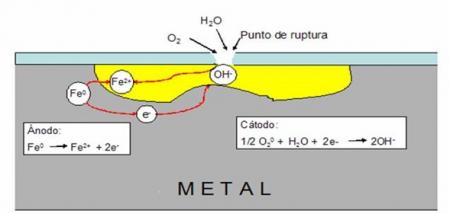
Observación: Un punto de tensión en un objeto de acero actúa como ánodo donde el hierro se oxida a iones Fe2+ y se forman hendiduras. Los electrones producidos fluyen a través del clavo hacia las áreas expuestas al O2. Estas actúan como cátodos donde el O2 (g) se reduce a iones hidróxido, (OH)-
Conceptos:
1) Procesos espontáneos: una reacción que sí ocurre en determinadas condiciones.
Raymond Chang y Kenneth A. Gold (2013) QUIMICA (pp. 802).
McGraw- Hill Companies. Inc.
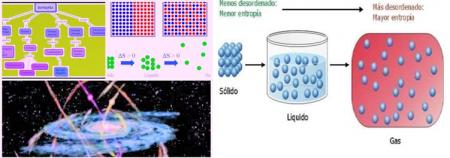
2) Entropía: suele describirse como una medida del grado de dispersión de la energía en un sistema entre las diferentes posibilidades en que ese sistema puede contener la energía. En otras palabras es el grado de desorden de un sistema.
Raymond Chang y Kenneth A. Gold (2013) QUIMICA (pp. 803).
McGraw- Hill Companies. Inc.
3) Microestados: es el total de formas en que las moléculas pueden ser distribuidas.
Y en 1868, Boltzmann demostró que la entropía de un sistema está relacionada con el logaritmo natural del número de microestados. Un sistema con menos microestados tiene menor entropía y un sistema con mayor microestados entre los cuales se puede esparcir mejor su energía (mayor dispersión) tiene mayor entropía.
Raymond Chang y Kenneth A. Gold (2013) QUIMICA (pp. 804).
McGraw- Hill Companies. Inc.
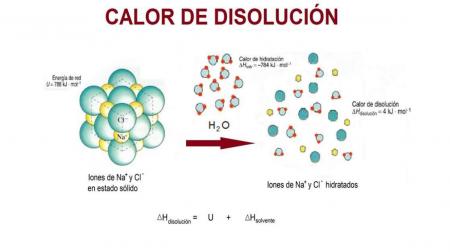
4) Cambio de entropía en el entorno: si el proceso es exotérmico en el sistema, el calor trasferido aumenta el movimiento de las moléculas de los alrededores, por ello aumenta la entropía en el entorno. Si el proceso es exotérmico en el sistema, este absorbe el calor del entorno y por tanto reducen los movimientos moleculares, por ende también la entropía del entorno.
Raymond Chang y Kenneth A. Gold (2013) QUIMICA (pp. 811).
McGraw- Hill Companies. Inc.
5) Energía libre de Gibbs: es la energía disponible para realizar trabajo.
Raymond Chang y Kenneth A. Gold (2013) QUIMICA (pp. 816).
McGraw- Hill Companies. Inc.
6) Energía libre estándar de reacción: es el cambio de energía libre en una reacción cuando se lleva a cabo en condiciones estándar, cuando los reactivos en su estado estándar se convierten en productos en su estado estándar.
Raymond Chang y Kenneth A. Gold (2013) QUIMICA (pp. 816).
McGraw- Hill Companies. Inc.
Aplicación:
1) La corrosión es un procesos espontaneo que experimentan los metales. Estos, al tener un contacto con el medio ambiente, experimentan un proceso de oxidación que gradualmente los va deteriorando, generando que estos pierdan su dureza. Este proceso es permanente ya que el metal está en constante contacto con el medio ambiente, ya sea una reja con el oxígeno del aire o un carro con el agua con que se lava o la lluvia, etc.
Una característica importante de los procesos de corrosión es que los eventos ocurren espontáneamente en la naturaleza, en términos termodinámicos, esto equivale a decir que la variación de energía libre (∆G0) de la reacción global es menor que cero.
La corrosión ordinaria, es un proceso redox por el cual los metales se oxidan por medio del oxígeno O2, en presencia de humedad. El oxígeno en estado gaseoso es un agente oxidante, y la mayoría de los metales tienen potenciales de reducción menores que éste, por lo tanto son fácilmente oxidables.
Se sabe que la oxidación de los metales tiene lugar más fácilmente en puntos donde la tensión es mayor (donde los metales son más “activos”). Así, un clavo de acero, que en su mayor parte es hierro, se corroe primero en la punta y en la cabeza. Un clavo doblado se corroe más fácilmente en el recodo.
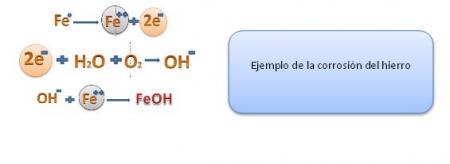
Algunos de los procesos más familiares de corrosión son la herrumbre del hierro y el acero y la formación de pátina verde en el cobre y sus aleaciones bronce y latón.
No siempre que se presenta la oxidación de un metal existe corrosión, en algunos casos el óxido formado es resistente y forma una capa gruesa de óxido que impide que el resto del material continúe oxidándose. Esto fenómeno es común en materiales de aluminio, zinc y magnesio.
Sin embargo, la corrosión es un fenómeno mucho más amplio que afecta aún materiales no metálicos (cerámicas, polímeros, etc.), que sufren corrosión mediante otros mecanismos dependiendo del medio ambiente.

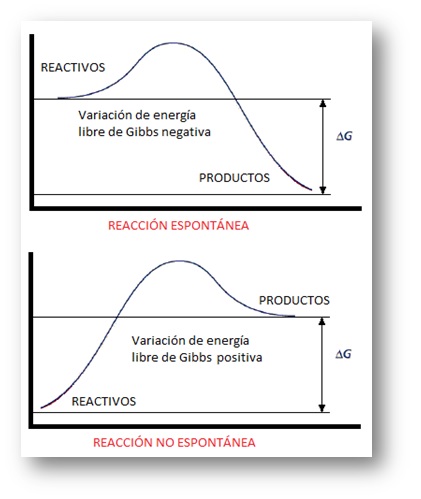
Importante: En la espontaneidad de un proceso influye el signo de la energía intercambiada y la variación en el desorden correspondiente a las partículas del sistema, de tal modo que, cualquiera que sea la temperatura a la que tenga lugar una reacción en la que se desprenda energía y aumente el desorden, dicha reacción será espontánea. Esta es la razón de que la mayor parte de las reacciones químicas que se verifican espontáneamente en condiciones estándar sean exotérmicas, es decir, se trate de reacciones en las que se desprende energía. En el caso de las reacciones exotérmicas la energía liberada se transforma, de energía en forma química, en otras formas como son energía térmica, luminosa o sonora; con cierta frecuencia van, además, acompañadas de emisión de llamas y humo.
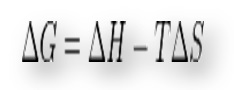
Es importante recalcar que este proceso de espontaneidad al igual que la variación de la energía libre de Gibbs son características que determinan las condiciones necesarias para el desarrollo de una reacción química. Esto es necesario para el desarrollo industrial a nivel internacional, además de hacer más efectivo el proceso químico. Sobre es más fácil usar el ∆H° o el ∆E o el ∆S o el ∆G que son funciones de estado y no depende del proceso de cambio.
BROWN, Theodore
2009 “Procesos espontáneos”. En PERSON EDUCACIÓN. Química, la ciencia central. Decimoprimera edición. México, PP. 802-821