Trabajo presentado por Equipo 3: Left 4 dead y Equipo Rocket
Conceptos clave
Ácidos y bases:
Según la definición de Arrhenius los ácidos son sustancias que producen iones H+ en agua y las bases son sustancias que producen iones OH- en agua. Luego de un tiempo, el concepto de ácidos y bases según Arrhenius se estableció de la siguiente forma:
-Un ácido es una sustancia que, cuando se disuelve en agua, aumenta la concentración de iones H+.
-Una base es una sustancia que, cuando se disuelve en agua, aumenta la concentración de iones OH–.
El concepto de Arrhenius sobre los ácidos y las bases, aunque es útil, tiene una limitación:
Está restringido a las disoluciones acuosas; debido a esto los químicos Johannes Bronsted y Thomas Lowry propusieron de forma independiente una definición más general de los ácidos y las bases. Su concepto se basa en el hecho de que las reacciones acido-base involucran la transferencia de iones H+ de una sustancia a otra.
BROWN, T. (2009) “Química La Ciencia Central”. Decimoprimera edición (pp. 668 – 670). Traducción de Laura Fernández Enríquez. México: PEARSON EDUCACIÓN
Hidrólisis:
Teniendo en cuenta que casi todas las sales son electrolitos fuertes, se puede asumir que cuando una sal se disuelve en agua, esta se disocia por completo. Debido a esto, las propiedades ácido-base de las disoluciones de sales se deben al comportamiento de los cationes y aniones que las constituyen. Muchos de estos iones pueden reaccionar con agua para generar H+(ac) o OH–(ac). A esta clase de reacción se le conoce frecuentemente como hidrólisis. En la hidrólisis las moléculas de agua se separan y reaccionan con otras sustancias, lo cual modifica el equilibrio y altera el pH.
BROWN, T. (2009) “Química La Ciencia Central”. Decimoprimera edición (pp. 695 – 696). Traducción de Laura Fernández Enríquez. México: PEARSON EDUCACIÓN
Auto ionización del agua:
Entre las propiedades químicas más importantes del agua está la capacidad de actuar como un ácido o una base según las circunstancias. En presencia de un ácido, el agua actúa como un aceptor de protones; sin embargo, en presencia de una base, el agua actuará como un donador de protones.
Gracias a esta capacidad una molécula de agua le puede donar un protón a otra molécula de agua. A este proceso se le conoce como auto ionización del agua.
BROWN, T. (2009) “Química La Ciencia Central”. Decimoprimera edición (pp. 673 – 674). Traducción de Laura Fernández Enríquez. México: PEARSON EDUCACIÓN
Constante de Ionización:
La constante de ionización es una constante de equilibrio de una disociación iónica, la cual es definida por la ecuación de la constante de equilibrio en función de las concentraciones molares que corresponden. En otras palabras, la constante de ionización es el producto de las concentraciones iónicas dividido por la concentración de la sustancia sin disociar.
Dependiendo de si la sustancia con la que tratamos sea un ácido o una base, nuestra constante de ionización se representará con “Ka” y “Kb” respectivamente.
BROWN, T. (2009) “Química La Ciencia Central”. Decimoprimera edición (pp. 681 – 693). Traducción de Laura Fernández Enríquez. México: PEARSON EDUCACIÓN
Efecto del ion común:
Siempre que un electrolito débil y un electrolito fuerte contengan un ion común, el electrolito débil se ioniza menos de lo que lo haría si estuviera solo en la disolución. A esta observación se le conoce como efecto del ion común. El efecto del ion común es el desplazamiento del equilibrio causado por la adición de un compuesto que tiene un ion común con la sustancia disuelta. Este efecto tiene una función importante en la determinación del pH de una disolución y en la solubilidad de una sal poco soluble. A pesar del nombre particular que se le da, cabe resaltar que el efecto del ion común sólo es un caso especial del principio de Le Châtelier.
Chang R., Goldsby K. (2013).Entropía, energía libre y equilibrio. En Química (pp. 698). México: McGraw Hill Education.
BROWN, T. (2009) “Química La Ciencia Central”. Decimoprimera edición (pp. 720). Traducción de Laura Fernández Enríquez. México: PEARSON EDUCACIÓN
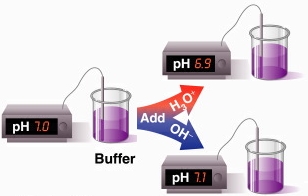
Buffer:
Buffer, también conocido como disolución amortiguadora o tampón, es una disolución de un ácido débil o una base débil y su sal; o sea, son necesarios ambos componentes. El buffer tiene la capacidad de resistir los cambios en el pH cuando se agrega ácido o base en pequeñas cantidades.
Chang R., Goldsby K. (2013).Entropía, energía libre y equilibrio. En Química (pp. 701 – 702). México: McGraw Hill Education.
Aplicaciones
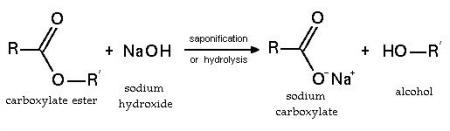
Hidrólisis
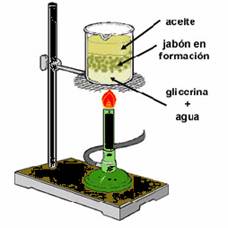
Un claro ejemplo de este proceso químico es la conocida “saponificación}2, qie es hervir grasa en enormes calderas. A tal proceso se le agrega NaOH, conocido como hidróxido de sodio y finalmente se mueve la mezcla.
Este proceso aplicado en el ámbito industrial genera glicerol (alcohol) y ácidos grasos (carboxílico), conocidos como el jabón y la glicerina
Referencia
Química
“Hidrólisis”. Química: La Ciencia Primera. Autor: Brown. Capítulo 16: Equilibrios ácido-base. Pag: 650. Consulta: 5 de Junio de 2014.
Soluciones Buffer
Como ya se definió, una solución buffer (o amortiguadora) es aquella que resiste el cambio de pH el cual se agrega a otra solución y le permite tener sus valores pH casi constantes.
Un ejemplo es aquel que vivimos día a día.
El pH de la sangre varía entre 7,3 y 7,5, lo que indica que si este es mayor a 7,9 o menor a 7 se produce la muerte.
Para que dicho pH no varíe se agrega una solución buffer de ácido carbónico y el ión bicarbonato , el cual se obtienen al respirar y reaccionar el con el plasma sanguíneo.
Referencia
Química
“Soluciones Amortiguadoras”. Química: La Ciencia Primera. Autor: Brown. Capítulo 17: Aspectos Adicionales de Los Equilibrios Acuosos. Pag: 664. Consulta: 5 de Junio de 2014.
Yahoo
“¿soluciones amortiguadoras en el cuerpo humano?”. Yahoo Respuestas. Consulta: 5 de Junio de 2014. <<https://espanol.answers.yahoo.com/question/index?qid=20100606172908AAMFyyx>>
