Trabajo realizado por el Equipo 2: GTA PUCP, REDOX, Titanio
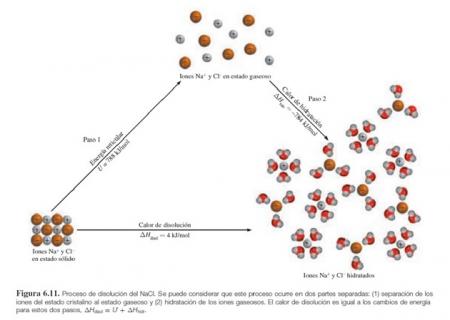
Imagen tomada de:
Chang Raymond (2007). Química (pp. 260).
USA: McGraw Hill
Palabras clave
Energía reticular: Es la energía requerida para separar completamente un mol de un compuesto sólido iónico en sus iones en estado gaseoso.
Chang Raymond (2007). Química (pp. 260).
USA: McGraw Hill
Calor de hidratación (∆H hidratación): Es el cambio de entalpia asociado al proceso de hidratación.
Chang Raymond (2007). Química (pp. 260).
USA: McGraw Hill
Calor de disolución: Es el calor generado o absorbido cuando cierta cantidad de soluto se disuelve en cierta cantidad de disolvente. Representa la cantidad de entalpia de la disolución final y la entalpia de los componentes originales (es decir soluto y disolvente) antes de mezclarse. Así
∆H disolución = H disolución – H componentes
Mediante la ley de Hess, es posible considerar ∆H disolución como la suma de ∆H hidratación y la energía reticular. Así
∆H disolución = ∆H hidratación + Energía reticular
Chang Raymond (2007). Química (pp. 260).
USA: McGraw Hill
Formación de disolución: Las disoluciones se forman cuando las fuerzas de atracción entre las partículas de soluto y de disolvente son de magnitud comparable con la de las que existen entre las partículas de soluto mismas o entre las partículas de disolvente mismas.
BROWN THEODORE L., y cols. Química. La ciencia central (pp.486)
USA: PEARSON EDUCATION
Proceso de disolución: Consiste en 3 etapas: Ruptura de las atracciones soluto-soluto (endotérmica), ruptura de las atracciones solvente- solvente (endotérmica), formación de solvente-soluto (exotérmica)
BROWN THEODORE L., y cols. Química. La ciencia central (pp.486)
USA: PEARSON EDUCATION
Disolvente y soluto: El disolvente es el componente que está presente en cantidad mayor o que determina el estado de la materia en la que existe una disolución. Los otros componentes de la disolución, denominados solutos se dice que están disueltos, en el disolvente.
Ralph H. Petrucci, William S. Harwood, F. Geoffrey Herring.(2003). Química General.
USA: PEARSON EDUCATION
Aplicación: Refrigeración por absorción
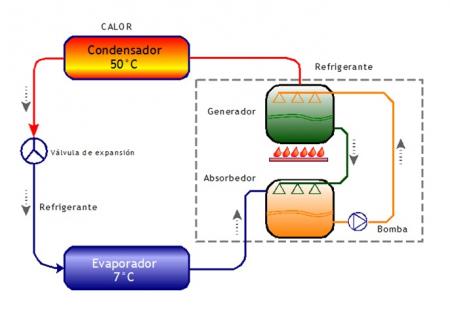
- Se emplea el bromuro de litio porque tiene gran capacidad de absorber agua y porque puede deshidratarse mediante el calor.
- El agua que se mueve por un circuito( a baja presión), se evapora en un intercambiador de calor (evaporador).
- žTras el evaporador el bromuro de litio absorbe el vapor de agua en el absorbedor, produciendo así una solución diluida o débil de bromuro en agua. Esta solución pasa al generador , donde se separan disolvente y soluto mediante calor de una fuente externa.
-
žEl agua va al condensador y de allí pasa al evaporador , a través de la válvula de expansión; el bromuro ahora como solución concentrada en agua, vuelve al absorbedor para reiniciar el ciclo.