PILA VOLTAICA
Equipo 3 (H-205): Nitrato de Pasar, KSiPaSO, Nitrato de Biquear
Imagen obtenida de: “Electroquímica” – Sin autor Fecha de consulta: 29/10/15 http://www.fq.uh.cu/dpto/%23qf/uclv/infoLab/infoquim/complementos/electroquimica/electroquimica.htm
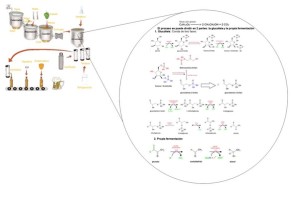
Nuestra aplicación es la pila voltaica, un sistema en el cual se aprovecha la energía generada en una reacción espontánea y es usada, en el caso de la imagen, para encender el foco. Cabe señalar que la tira de zinc dentro de la disolución de ácido sulfúrico diluido actúa como un ánodo y la tira de cobre dentro de la disolución de sulfato de cobre actúa como un cátodo, además, el puente salino que se encuentra en el caso de la imagen es de cloruro de potasio, el cual sirve para que los electrones fluyan entre los envases sin mezclar sus contenidos.
Al ver los dos sistemas en la imagen, se observa que el sistema de la izquierda se encuentra abierta y por eso no se genera energía, esto ocurre porque es necesario que sea un sistema cerrado en donde la energía pueda liberarse o en el caso de que el sistema se cierre con una fuente de electricidad ocurrirá lo contrario y el sistema absorberá energía, logrando invertir así el proceso de oxidación-reducción y convertir al sistema en una célula electrolítica; Por otro lado, se observa que en el sistema de la derecha la reacción genera energía, además podemos notar que la tira de zinc se consume hasta desaparecer, esto se debe a que sufre una oxidación, mientras que la tira de cobre crece al producir metal adicional, ya que sufre una reducción.
Electroquímica, es una parte de la química que trata de la relación entre las corrientes eléctricas y las reacciones químicas, y de la conversión de la energía química en eléctrica y viceversa. El tema se puede dividir en dos sub-ramas fundamentales:
- Electrólisis: el estudio de las reacciones químicas causadas por una corriente eléctrica
- La otra parte se centra en las reacciones químicas que producen una corriente eléctrica, las cuales dichos procesos se llevan a cabo en una pila galvánica
Una reacción importante en el desarrollo de la electroquímica son las reacciones de oxidación – reducción (REDOX). Bajo dicho contexto, se sabe que una reacción REDOX posee agente oxidante, una especie oxidada, un agente reductor, y una agente reducida. Sin embargo, cuando las reacciones REDOX sean espontáneas y dentro de un sistema cerrado, producen cargas eléctricas.
En nuestra aplicación presenciamos como se produce energía eléctrica, mediante una reacción química, que puede ser usada para encender un foco. De esta manera, se observa que la electroquímica posee un uso valioso en el aprovechamiento de la energía liberada por reacciones químicas de oxidación-reducción. De acuerdo a lo mencionado se puede deducir que la mayoría de usos que se le ha venido dando a este concepto es el de pilas, baterías o celdas capaces de almacenar energía.
En la pila voltaica se produce una reacción electroquímica en la que el cobre cede electrones a la disolución y el zinc los gana. Al mismo tiempo, el zinc se disuelve y se produce gas hidrógeno en la superficie del cobre, el hidrógeno producido en la reacción queda adherido a la superficie del cobre, haciendo disminuir rápidamente la intensidad de corriente. Este fenómeno recibe el nombre de polarización del electrodo y se evita con la utilización de una sustancia oxidante que reacciona con el hidrógeno formando agua y se denomina agente despolarizante.
Bibliografía:
- AUTOR DESCONOCIDO
“Electroquímica” Consulta: 27 de octubre del 2015
http://www.fq.uh.cu/dpto/%23qf/uclv/infoLab/infoquim/complementos/electroquimica/electroquimica.htm
- ECURED
“Electroquímica” Consulta: 27 de octubre del 2015
http://www.ecured.cu/index.php/Electroqu%C3%ADmica
- AARONIT
“Electroquímica” Consulta: 26 de octubre del 2015
http://www.monografias.com/trabajos89/la-electroquimica/la-electroquimica.shtml
- THEODORE BROWN
“Química, la ciencia central” (páginas 842 – 891) Consulta: 26 de octubre del 2015
- RENA
“Electroquímica” Consulta: 28 de octubre del 2015
http://www.rena.edu.ve/cuartaEtapa/quimica/Tema15.html
TRATAMIENTO DE AGUAS RESIDUALES
Equipo 5 (H-206): Eureka, Nitrato de Biquear, Los Yakuza
Mediante la aplicación de un campo eléctrico entre ánodos y cátodos de materiales específicos según el residual agua a tratar, aunque el ánodo suele ser de titanio recubierto con sinterizados a partir de metales nobles con propiedades catalíticas que permiten oxidar los contaminantes por contacto directo con el ánodo o por oxidación en el medio. En esta, se genera una fuerza electromotriz a partir de la aplicación de corriente eléctrica continua a bajo voltaje con el fin de generar reacciones como roturas moleculares, redox, absorción química y electroquímica, separación y rotura de emulsiones y aceites, entre otros. Estas reacciones son las que contribuyen en la desestabilización de las moléculas contaminantes provocando su precipitación y oxidación a compuestos más biodegradables reduciendo la producción de lodos en todo el proceso.
Bibliografía