Trabajo realizado por Equipo 1: Los stones, REDOXON, Los Moralitos
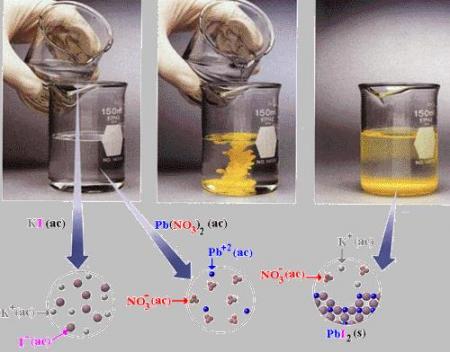
Aquí podemos observar, experimentalmente, los diferentes procesos de reacción hasta llegar al equilibrio.
Tomado de: vínculo
Conceptos clave
- Reacciones químicas reversibles: Las reacciones reversibles son aquellas en las que los reactivos no se transforman totalmente en productos, ya que éstos vuelven a formar los reactivos, dando lugar así a un proceso de doble sentido que desemboca en equilibrio químico.
Jordan Castillo (2012, 2 de abril) Blog: Reacciones reversibles e irreversibles. Recuperado el 6 de junio del 2014, de: http://quimicaconota.blogspot.com/2012/04/reacciones-reversibles-e-irreversibles.html
- Constante de equilibrio: es una medida de posición que indica si una reacción química está desplazada hacia los productos (reacción directa), es decir, mayor formación de productos; o, si está desplazada hacia los reaccionantes o reactivos (reacción inversa), en este caso mayor disociación de productos para volver a formar los reaccionantes.
RENA (Red Escolar Nacional). Tema 5: Equilibrio Químico. Recuperado el 6 de junio del 2014, de: http://www.rena.edu.ve/cuartaEtapa/quimica/Tema5.html
- Equilibrio Homogéneo: está formado por una única fase. Esto quiere decir que, desde el punto de vista de la química, exhibe propiedades intensivas del mismo valor en todos sus puntos.
UNAD (Universidad Nacional Abierta y a Distancia) Lección 8: Equilibrio homogéneo y heterogéneo. Recuperado el 6 de junio del 2014, de: http://datateca.unad.edu.co/contenidos/358005/contLinea/leccin_8__equilibrio_homhomho_y_heterogneo.html
- Equilibrio Heterogéneo: En los equilibrios heterogéneos las especies se encuentran en fases distintas, es decir el sistema presenta más de una fase.
Instituto Tecnológico de Costa Rica. Escuela de Química. Unidad 4 – Equilibrio. Recuperado el 6 de junio del 2014, de: http://www.tec-digital.itcr.ac.cr/file/2482748/Unidad_4_equilibrio_quim_I_parte_rev_GCP.pdf
- Principio de Le Chatelier: Cuando en una reacción química en equilibrio se modifica la presión, la temperatura o la concentración de alguna de las especies reaccionantes, la reacción evoluciona en uno u otro sentido hasta alcanzar un nuevo estado de equilibrio. Modificando alguno de estos factores se puede aumentar o disminuir el rendimiento de la reacción.
Universidad Nacional de Luján. Química General – El principio de Le Chatelier. Recuperado el 6 de junio del 2014, de: http://www.unlu.edu.ar/~qgeneral/lechatlier.PDF
- Grado de disociación: Puesto que en muchas reacciones los reactivos no se transforman completamente en productos, es útil definir el grado de disociación de un reactivo como el cociente entre el número de moles de ese reactivo que han aparecido al establecerse el equilibrio y el número de moles iniciales del mismo al comienzo de la reacción, multiplicado por 100. Dichas cantidades pueden medirse en moles o en magnitudes proporcionales.
Química 2 ° Bachillerato. Bloque Vll: Equilibrio Químico. Recuperado el 6 de junio del
2014, de: http://www.ieslaaldea.com/documentos/fisicayquimica/equilibrioquimico.pdf
Aplicaciones
Todos los procesos químicos evolucionan desde los reactivos hasta la formación de productos y a una velocidad que cada vez es menor, ya que a medida que transcurren, hay menor cantidad de reactivos. Por otro lado, según van apareciendo moléculas de los productos, estas pueden reaccionar entre sí y dar lugar nuevamente a reactivos, y lo hacen a una velocidad mayor pues cada vez hay más. El proceso continúa hasta que la velocidad de formación de los productos es igual a la velocidad de descomposición de estos para formar nuevamente los reactivos. Es decir, se llega a la formación de un estado dinámico en el cual las concentraciones de todas las especies reaccionantes (reactivos y productos) permanecen constantes. Ese estado se conoce como equilibrio químico.
El equilibrio en fase gas, aplicado en los motores de cohete.
Los motores cohete producen el empuje por la expulsión a alta velocidad un fluido. Este fluido es, casi siempre, un gas generado por la combustión dentro de una cámara de combustión a alta presión (10-200 bar) de propergoles sólidos o líquidos, que consta de dos componentes combustible y oxidante.
El escape de fluido se hace pasar a través de una tobera de propulsión supersónica que utiliza la energía calorífica del gas para acelerar el escape a una velocidad muy alta, y la fuerza de reacción a esta empuja el motor en la dirección opuesta.
En los motores cohete las altas temperaturas y presiones favorecen el buen rendimiento pues permite montar toberas más largas en el motor, lo que proporciona mayores velocidades de escape, así como un mejor rendimiento termodinámico.
Es tan amplia la aplicación del equilibrio químico que aún en lo cotidiano y más simple como, al bañarse, se produce el equilibrio químico en la disolución entre los químicos del jabón. En la industria, Abarcar las innumerables aplicaciones de equilibrio químico que existen será casi interminable por lo se nombrará pocas de ellas.
Algunas máquinas como los vaporizadores y las bombas centrífugas entre otros equipos mecánicos requieren el conocimiento perfecto del valor de la constante de equilibrio para determinar en qué aparato se utilizaron. Así por ejemplo, el vaporizador de tubos, se requieren un conocimiento conciso y preciso de los procesos, y en su aplicación, en donde los tubos se puede determinar si es un sistema cerrado en donde si hay o no hay transferencia de calor, ya que muchas veces la transferencia de calor puede ser sumamente importantes y manejar el comportamiento para poder manejarlos adecuadamente ya que esto reduce costos y se aprovechan al máximo para obtener mayor eficiencia en la industria.
La industria cervecera es muy usada para determinar el tiempo y velocidad de la fermentación de la cebada y así tener un presupuesto monetario dependiendo del tiempo.
En la producción de cemento se debe determinar la temperatura ideal a la que se debe someter los reactivos para lograr la producción más eficiente de cemento.
El conocimiento y entendimiento del equilibrio de una simple reacción química es un gran y esencial paso para el desarrollo humano que siempre busca mejoras continuas para su beneficio.
McGraw-Hill Interamericana de España, SL. Recuperado el 6 de junio del 2014 de:
