Trabajo presentado por Equipo 2: REDOX y Titanio (GTA-PUCP no participó)
Fuente:
http://grupoorion.unex.es:8001/rid=1J4ZDZVJL-1KCTZRW- 2HML/ACIDOS%20Y%20BASES%20(LAura%20Pe%C3%B1as).cmap
Conceptos clave
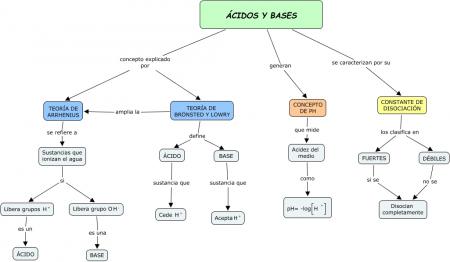
Ácidos fuertes: Son electrolitos fuertes que para fines prácticos, se supone que se ionizan completamente en el agua. La mayoría son ácidos inorgánicos como el HCl, HNO3, HClO4 y el H2SO4. En el equilibro, las disoluciones de los ácidos fuertes carecen de moléculas de ácido sin ionizar
Chang Raymond (2007). Química (pp. 652).
USA: McGraw Hill
Ácidos débiles: Son sustancias que se ionizan, sólo en forma limitada, en el agua. En el equilibrio, las disoluciones acuosas de los ácidos débiles contienen una mezcla de moléculas del ácido sin ionizar, iones H3O+ y la base conjugada.
Chang Raymond (2007). Química (pp. 652).
USA: McGraw Hill
Bases fuertes: Al igual que los ácidos fuertes, son electrolitos fuertes que se ionizan completamente en el agua. Son incapaces de aceptar un protón; sin embargo, el ion hidroxilo (OH–) que se forma en la ionización, sí puede aceptar un protón.
Chang Raymond (2007). Química (pp. 653).
USA: McGraw Hill
Bases débiles: Al igual que los ácidos débiles, son electrolitos débiles. En agua se ionizan de forma muy limitada.
Chang Raymond (2007). Química (pp. 653).
USA: McGraw Hill
Constante del producto iónico ( Kw) : Es el producto de las concentraciones molares de los iones H+ y OH– a una temperatura particular. La siguiente relación siempre se cumple a 25°C :
Kw= [H3O+] [OH–]=[H+] [OH–]
Chang Raymond (2007). Química (pp. 648).
USA: McGraw Hill
El pH : Puesto que las concetraciones de los iones H+ y OH– en disoluciones acuosas con frecuencia son números muy pequeños y, por lo tantoSoren Sorensen propuso, en 1909, El pH de una disolución se denomina como el logaritmo negativo de la concentración del ión hidrógeno (en mol/L):
pH= -log[H3O+] o pH= -log[H+]
Además, debido a que el pH sólo es una manera de expresar la concentración del ión hidrógeno, las disoluciones ácidas y básicas a 25°C se identifican por sus valores del pH, como sigue:
Disoluciones ácidas: [H3O+] > 1.0×10-7 M, pH < 7.00
Disoluciones básicas: [H3O+] < 1.0×10-7 M, pH > 7.00
Disoluciones neutras: [H3O+] = 1.0×10-7 M, pH = 7.00
Además, [H3O+] = 10-pH
Chang Raymond (2007). Química (pp. 649).
USA: McGraw Hill
Aplicaciones
Neutralización de aguas residuales
Como aguas residuales se les conoce a los residuos líquidos provenientes de las distintas áreas y procesos de cada industria. Si esta agua fuera directamente arrojada al medio ambiente, se produciría una contaminación ambiental masiva, ya que esta agua normalmente es portadora de productos químicos muy dañinos para la persona y plantas. Por ello nace la necesidad de procesar esta agua en una planta de tratamiento de aguas residuales o efluentes, en las que se aplican tratamientos físicos, biológicos y químicos, para arrojarla sin los residuos dañinos. La etapa física tiene por objetivo el asentamiento de sólidos pesados, reducción de aceites, grasas y arenas. La etapa biológica, tiene por objetivo degradar las bacterias y otros contenidos biológicos de las aguas residuales. En la última etapa se aplica un proceso de desinfección cuyo objetivo es llevar el agua a los estándares aprobados por cada legislación antes de su descarga. Es para esta etapa que se emplea la medida y regulación de pH, siendo muy importante para cumplir dichos estándares.
Industria minera: Los procesos mineros son muy contaminantes debido a la continua adición de metales pesados, que hacen del agua, un producto inutilizable para el riego o evacuación sin previo aviso .el tratamiento de las aguas residuales, porque los procesos son muy contaminantes, ya que adicionan en esta agua metales pesados que los hacen inutilizables para el riego o evacuación sin un previo tratamiento. Para regular la salida se trabaja con todas las fases antes expuestas y la neutralización con ácidos y bases para que puedan ser desechados a los ríos.
Industria alimentaria: En este tipo de industrias no se añaden normalmente tantos metales pesados, pero hay mucho uso de sustancias químicas que son evacuadas en las aguas residuales y por ello también es muy importante contar con una planta de tratamientos de efluentes para la posterior descarga.
Universidad de Piura. Importancia del pH en las industrias y módulo de laboratorio: Neutralización de aguas residuales. Recuperado el 08 de junio de 2014, de: http://www.biblioteca.udep.edu.pe/bibvirUDEP/tesis/pdf/1_197_184_140_1851.pdf
Como vemos en el texto anterior, para que el agua pueda ser usada por las personas necesita estar en los niveles estándar de potencial hidrogeno (pH) esto es entre 7.2 y 7.6. Para regular el pH del agua se usan ácidos y bases. Si el pH es alto se usa un ácido como ácido clorhídrico, si el pH es menor a los estándares se usa una base alcalina como el bicarbonato de sodio.
De esta manera vemos como los ácidos y las bases sirven para prevenir problemas de salud que pueden ser producidos por aguas contaminadas. Concluimos, entonces, que los ácidos y las bases son muy útiles en la vida cotidiana en distintos aspectos.
