[Visto: 5631 veces]
Trabajo presentado por el Equipo 4: Reacción 0. H2O2, Quimitube
Fuente:
http://3.bp.blogspot.com/_gdF2rNEjn8I/TEyNImRKoDI/AAAAAAAAAGI/62oxcmi-xzc/s1600/6.gif
CONCEPTOS CLAVE
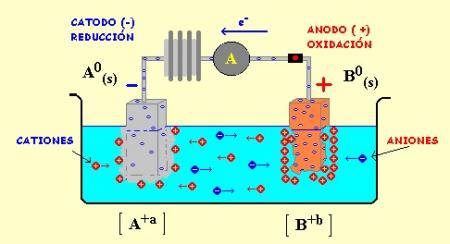
- Celda electroquímica: Es un dispositivo capaz de obtener energía eléctrica a partir de reacciones química.
BIBLIOGRAFIA:
Química. American ChemicalSociety. Editorial Reverté, 2005. ISBN: 8429170014. Pág. 680
- Reacción electroquímica: Es la secuencia paso a paso de las etapas elementales, que participen al menos en un electrón cerrado, por la cual en general se produce un cambio químico.
BIBLIOGRAFIA:
- Voltímetro: Es un instrumento que sirve para medir la diferencia de potencial entre dos puntos de un circuito eléctrico.
- Electrodo: Es un conductor eléctrico utilizado para hacer contacto con una parte no metálica de un circuito.
- Pilas galvánicas o voltaicas: Proporcionan energía eléctrica a partir de la energía química.
- Pilas electrolíticas: Proporcionan energía quimica a partir de energía eléctrica.
- Puente salino: Un puente salino consiste de un tubo en forma de U que contiene una disolución electrolítica como , cuyos iones no reaccionan con otros iones en la celda o con los materiales de los electrodos. Con frecuencia el electrolito se incorpora a una pasta o gel de que la disolución electrolítica no se derrame cuando se invierte el tubo en forma de U. Al llevarse a cabo la oxidación y a reducción en los electrodos, los iones del puente salino migran para neutralizar la carga en los comportamientos de la celda. Cualquiera que sea el medio para permitir que los iones migren entre las medias celdas, los aniones siempre migran a través del ánodo y los cationes a través del cátodo.
BIBLIOGRAFIA:
Brown, Theodore L..,cols. (2009) Química La Ciencia Central decimo primera edición (pp852-853) PEARSON EDUCACION, México.
APLICACIONES
- El funcionamiento de las baterías de ion de litio y de las baterías en general está basado en las celdas galvánicas dado que el proceso genera electricidad.
BIBLIOGRAFIA:
(http://es.wikipedia.org/wiki/Bater%C3%ADas_de_ion_de_litio)
- El galvanizado (galvanoplastia) como proceso “básico” para prevenir la oxidación. Por ejemplo, es muy común el recubrimiento de láminas de hierro con zinc para que este último lo proteja de la oxidación.
BIBLIOGRAFIA:
