- Calor: es la transferencia de energía a través de la interacciones térmicas por medio de dos materiales.
Guillermo Estefani. (2013, Abril). ¿QUÉ ES EL CALOR?: recuperado el 18 de abril del 2015, de:
http://www.artinaid.com/2013/04/que-es-el-calor/
- Disolución: es el hecho de que el soluto sea diluido en un solvente. Por ejemplo: una sustancia como la Sal común mezclada en agua.
DAHB. (2010, 28 de junio). Calor de disolución y dilución. Recuperado el 18 de abril del 2015, de:
http://zona-quimica.blogspot.com/2010/06/calor-de-disolucion-y-de-dilucion.html
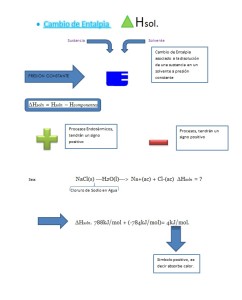
- Reacciones Endotérmicas: cuando existe una reacción entre dos o más sustancias estos conforman un sistema este sistema genera una entalpia. Si esta entalpia es positiva esto significa que la reacción a sido endotérmica, En otras palabra está a absorbido calor.
(2015) .Teoría 9 termoquímica: Definición de la entalpia de reacción estándar. Reacciones de endotérmicas y reacciones exotérmica. Diagramas entalpicos .Recuperado el 18 de abril del 2015, de:
http://www.quimitube.com/videos/definicion-de-entalpia-de-reaccion-endotermica-y-exotermica
- Reacciones Exotérmicas: cuando la entalpia de una reacción es negativa esta resulta ser una reacción exotérmica lo cual quiere decir que la reacción que libera calor.
(2015) .Teoría 9 termoquímica: Definición de la entalpia de reacción estándar. Reacciones de endotérmicas y reacciones exotérmica. Diagramas entálpicos .Recuperado el 18 de abril del 2015, de:
http://www.quimitube.com/videos/definicion-de-entalpia-de-reaccion-endotermica-y-exotermica
- Soluto: es la sustancia que, por lo general, se encuentra en menor cantidad y que se disuelve en la mezcla. Además suele ser un sólido que se contiene un unas soluciones liquidas. Por ejemplo: NaCl (s).
Biridianalaguna. (2011, 5 de junio). Definición de Soluto y Solvente. Recuperado el 18 de abril del 2015, de:
http://es.scribd.com/doc/57108468/Definicion-de-Solvente-Soluto-Masa-Volumen#scribd
- Solvente: es la sustancia que se puede disolver, aparece en mayo cantidad y permite que el soluto se disuelva. Por ejemplo: H2O (l).
Biridianalaguna. (2011, 5 de junio). Definición de Soluto y Solvente. Recuperado el 18 de abril del 2015, de:
http://es.scribd.com/doc/57108468/Definicion-de-Solvente-Soluto-Masa-Volumen#scribd
- Aplicación:
Ácido Sulfúrico:
El calor de disolución es importante, ya que permite conocer la transferencia de calor o entalpia en las reacciones químicas para determinar la condición exotérmica o endotérmica de las mismas. Además, es el cambio de calor asociado al proceso de dilución. Si cierto proceso de disolución es endotérmico y dicha disolución se diluye posteriormente, la misma disolución absorbe más calor de los alrededores. Lo contrario ocurre para un proceso exotérmico de disolución: se libera más calor si se añade más disolvente para diluir la disolución. . Un proceso importante puede producirse con el Ácido Sulfúrico.
Ácido Sulfúrico:
H2SO4 (l) H+ (aq) + HSO4– (aq)
Una pequeña ampolla de vidrio que contiene Ácido Sulfúrico se coloca en un calorímetro con agua. Cuando se rompe la ampolla, el ácido se disuelve en el agua y el calor de la reacción se transfiera al agua y al calorímetro.
En el proceso se concluye que el ácido sulfúrico es altamente exotérmico, es decir, que el proceso libera calor. Resulta peligroso disminuir su concentración agregando agua, ya que El ácido sulfúrico concentrado H2SO4 está constituido por 98% de ácido y 2% de agua en masa y ello produce que la disolución del ácido hierva y se proyecte fuera del recipiente. En conclusión, es muy importante el calor de disolución, porque con ello se podría analizar si el soluto más el solvente genera una solución que libera o absorbe energía. Además de prevenir en agregar o disminuir el solvente como se produjo en el caso del ácido sulfúrico.
Referencias:
-Raymond Chang Kenneth, A. Goldsby, “Química” 11°edicion (2013) The McGraw-Hill
-Juan María Fernández, Aulas Virtuales del IES Jorge Manrique (Palencia/España) de:
http://aulas.iesjorgemanrique.com/calculus/quimica2/Calorimetry/CalordedisolucionAcidoSulfurico.html