Imágenes tomadas de:
BALAREZO, MAURO
2012 “Retardantes de llama”. Pro Seguridad C.A. Valencia, 2012, Consulta: 24 de Abril de 2012.
< http://www.proseguridad.com.ve/incendios/retardantes-de-llama/>
ARTINAID
2013 “La Combustión”. Consulta: abril de 2013
< http://www.artinaid.com/2013/04/la-combustion/>
SIEMPRE EN LAS NUBES
2013 “¿Cuánto calor genera el quemador de un globo?”. Consulta: 1 de febrero de 2013
< http://siempreenlas-nubes.blogspot.com/2013/02/cuanto-calor-genera-el-quemador-de-un.html>
NAKKA, RICHARD
2007 “Teoría sobre motores cohete de propelente solido”. Consulta: 19 de abril de 2015
< http://nakka-rocketry.net/articles/teoria_de_los_motores_cohete.pdf >
Listado de conceptos clave
- Calor de combustión
Cedrón J.; Landa V.; Robles J. (2011). Cálculo de calor de reacción: Entalpías de Formación. Recuperado el 18 de abril del 2015, de: http://corinto.pucp.edu.pe/quimicageneral/contenido/141-calculo-de-calor-de-reaccion-entalpias-de-formacion.html
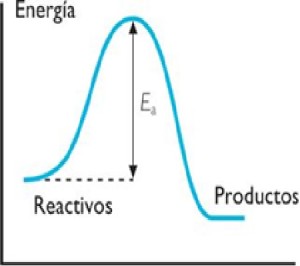
- Se define Calor de combustión o entalpía de combustión, al calor liberado por la combustión de 1 mol de sustancia en presencia de suficiente oxígeno. Siempre las reacciones de combustión liberarán calor, por lo tanto serán reacciones exotérmicas.
- Reacción exotérmica
- Cuando una reacción libera energía en forma de calor o energía térmica al entorno se dice que la reacción es exotérmica. En esta reacción, la energía contenida en los reactivos es mayor que la requerida en la formación de los productos, por esta razón la energía no utilizada se libera.
Raquel Enríquez García (2011). Reacciones exotérmicas y endotérmicas. Recuperado el 18 de abril del 2015, de: http://prepa8.unam.mx/academia/colegios/quimica/infocab/unidad114.html
- Reacción de combustión
Dr. Ing. E. Brizuela – Dra. Ing. S. D. Romano (2011). Combustión – Unidad I. Recuperado el 18 de abril del 2015, de:
http://materias.fi.uba.ar/6730/Tomo1Unidad1.pdf
- La reacción de combustión se basa en la reacción química exotérmica de una sustancia (o una mezcla de ellas) denominada combustible, con el oxígeno. Como consecuencia de la reacción de combustión se tiene la formación de una llama. Dicha llama es una masa gaseosa incandescente que emite luz y calor.
- Energía térmica
Ing. Rivadeneyra (2009). Energía térmica. Recuperado el 18 de abril del 2015, de:
http://www.energyeducation.tx.gov/energy/section_1/topics/forms_of_energy/thermal_energy.HTML
- La energía térmica o calorífica es la parte de energía interna de un sistema termodinámico en equilibrio que es proporcional a su temperatura absoluta y se incrementa o disminuye por transferencia de energía, generalmente en forma de calor o trabajo, en procesos termodinámicos.
- Calorimetría
Prof. Delmar Larsen (2005). Calorimetry. Recuperado el 18 de abril del 2015, de:
http://chemwiki.ucdavis.edu/Physical_Chemistry/Thermodynamics/Calorimetry
- Es el proceso de medir la cantidad de calor liberado o absorbido durante una reacción química. Al conocer el cambio en el calor, se puede determinar si una reacción es exotérmica (libera calor) o endotérmica (absorbe calor). La calorimetría también juega una parte importante en la vida cotidiana, como en el control de las tasas metabólicas de los seres humanos y por lo tanto el mantenimiento de este tipo de funciones como la temperatura corporal.
- Comburente
Ing. Marlon Rivas (2012). Sustancias Comburentes. Recuperado el 18 de abril del 2015, de:
http://es.slideshare.net/marialejitach/sustancias-combuerentes
- Un comburente es cualquier sustancia que en ciertas condiciones de temperatura y presión puede combinarse con un combustible, provocando así una combustión. Actúa oxidando al combustible y por lo tanto siendo reducido por este último.
Aplicaciones
Cohetes
Una de las aplicaciones más directas del calor de combustión se da en el funcionamiento de los motores de los cohetes a través de la combustión del propelente. El proceso de combustión del propelente es vital, debido a que su transformación a gases de alta temperatura tienen que cumplir con ciertos requerimientos para lograr un buen rendimiento del motor controlando su velocidad de despegue, su fuerza de empuje y la velocidad de quemado del combustible
Se sabe que la combustión del propelente es completa y no varía según lo asumido en la ecuación de combustión. El propelente puede ser conformado por un composición sencilla formada por combustible y oxidante con bases de azucares cuando el amateur. Cuando es profesional es más complejo tiene varios tipos de oxidantes como los polímeros unificadores y hasta metales como el aluminio
El principio bajo el que opera un motor e convertir la energía calórica de las reacciones químicas, en energía cinética. En otras palabras el calor liberado por la combustión da energía calórica y la velocidad de los productos de escape liberados por el motor gana energía cinética. Esto se logra en base a la ley de la conservación de la energía
C12H22O11 + 6,29 KNO3 -> 3,80 CO2 + 5,21 CO + 7,79 H2O + 3,07 H2 + 3,14 N2 +
3 K2CO3 + 0,27 KOH
Como la combustión es una simple reacción química exotérmica, está representada por la ecuación anterior de la forma reactivos y productos con un propelente de Kn/Sucarosa. Este es quemado presión constante y forman un producto que se encuentra en un estado de equilibrio químico
En primer lugar se tienen que reconocer los productos que se podría producir para cada tipo de propelente, posteriormente se calcula el número a través de balance de masas para establecer una relación entre reactivos y productos. Se sabe que la combustión es adiabática, por lo que podemos usar la ley de la conservación de la energía utilizando entalpias
Se puede ver como la entalpia de calor está involucrada en la reacción química
Esta ecuación es muy útil, porque a través de entalpia de combustión nos permite calcular la temperatura de combustión, a la que se suele llamar Temperatura Adiabática de Flama. De este modo se van calculando distintas variables que permiten que la combustión tenga un buen rendimiento
NAKKA, RICHARD
2007 “Teoría sobre motores cohete de propelente sólido”. Consulta: 19 de abril de 2015
< http://nakka-rocketry.net/articles/teoria_de_los_motores_cohete.pdf >