Autores: Guerra Guerra, Karla Yadira Lujan Vera, Fernando Jose Mateos Villena, Juan Pablo Tuesta Vargas, Mariano Valentin Vivanco Yaringaño, Eduard Whiler
- ¿Qué es un mineral?
Es una sustancia de origen natural, inorgánica, generalmente sólida, que posee una composición química definida y una estructura interna ordenada.
- Ley de un mineral, composición porcentual y pureza:
Se denomina como Ley del mineral al grado de pureza en que se encuentra la especie mineral en la roca de un yacimiento. La ley de cobre expresa el porcentaje de cobre que encierra una determinada muestra. Cuando se habla de una ley del 1% significa que en cada 100 kilogramos de roca mineralizada hay 1 kilogramo de cobre puro.
Esta se expresa en porcentaje (%) para los metales base ( aluminio, cobre, plomo, zinc, etc.), por ejemplo:
4.1 % = 4.1 kg/t , esto significa que existen 4.1 kg del mineral por cada 1000 kg de roca o material en el yacimiento.
Para los metales preciosos ( oro, plata, platino, etc.) la ley se expresa en gramos por tonelada u onzas por tonelada, por ejemplo: 32 g/t o 1.128 onzas/t
Asimismo, si es que, por ejemplo, se tiene una ley de oro de 20 g/t, es decir, 20 gramos de oro por 1000000 de gramos de material, es válido expresar la concentración en ppm (partes por millón), teniendo así un valor de 20 ppm para este caso.
La composición porcentual es usada para referirse a la cantidad de masa que ocupa un elemento en un compuesto. Para esto, se hace uso de los pesos atómicos de cada elemento y se haya el porcentaje de masa que representan, según cuantos átomos del elemento haya en la molécula, de la masa total de la molécula. Por ejemplo:
Agua (H2O): ¿Cuál es la composición porcentual de Oxígeno?
Peso atómico del hidrógeno = 1 Peso atómico del oxígeno = 16
Peso molecular = 1*2 + 16*1 = 18
Composición porcentual de Oxígeno = (16*1/18)*100% = 88.889 %
La pureza se refiere al porcentaje de sustancia pura que existe en una muestra o porción de sustancia, es decir, para alguna muestra de cierta cantidad de algún mineral en específico, la cantidad efectiva del mineral libre de impurezas podría ser cualquier otra cantidad menor a la previamente indicada.
- ¿Qué son los metales?
Los metales son un conjunto de elementos químicos que poseen una serie de características físicas y químicas que los hacen especiales y los diferencian de los demás elementos de la tabla periódica, como su alta conductividad, etc.
Ya que la mayoría de metales están presentes en minerales, se necesitan procesos de extracción para poder ser usados. A estos procesos de extracción se les conoce como refinación. Todos estos procesos se estudian en la metalurgia. La metalurgia es la ciencia y tecnología de la extracción o separación de metales a partir de sus menas y de la producción de aleaciones para usos prácticos. Una aleación es un material metálico compuesto de un metal y otro elemento. Los pasos que generalmente se siguen para la extracción de metales son:
- Exploración y explotación de menas
- Concentración o preparación de la mena para tratamientos ulteriores
- Reducción de la mena para obtener el metal libre
- Refinamiento o purificación del metal
- Mezclado del metal con otros elementos (Solo en caso de necesitar una aleación)
- Refinamiento:
Para el refinamiento de las menas se usa el proceso de reducción ya que, los metales en sus formas combinadas, siempre tienen números de oxidación positivos. La forma de obtener un metal puro en un proceso de reducción depende del potencial estándar de reducción del metal. A pesar de que todos pueden ser refinados por procesos de refinación, estos, se dividen según el potencial estándar de reducción en: procesos de pirometalúrgicos, hidrometalúrgicos y electrometalúrgicos.
Algunos procesos de reducción se presentarán en la siguiente tabla:
|
Metal |
Proceso de reducción |
| Litio, sodio, magnesio, calcio | Reducción electrolítica |
| Aluminio | Reducción electrolítica |
| Cromo, manganeso, titanio, vanadio, hierro, zinc | Reducción del óxido metálico con un metal más electropositivo |
Proceso Pirometalúrgico: En este proceso metalúrgico se utiliza el calor como principal fuente de energía para cambiar o reducir el mineral. En otras palabras, se requiere de temperaturas elevadas para modificar el mineral químicamente y reducirlo a metal libre.
En la naturaleza, los metales se encuentran combinados químicamente con otros elementos, los cuales deben ser tratados para poder obtener el metal. La secuencia de este proceso incluye tres etapas:
Preparación de los minerales:
En esta etapa, se busca optimizar el mineral mediante diferentes tipos de operaciones. Primero, se busca triturar y moler el mineral para reducir su tamaño. Esta operación se realiza con materiales secos. A continuación, se procede a clasificar las partículas de los minerales por tamaño mediante clasificadores mecánicos o hidráulicos. Finalmente, se separa del mineral la mayor parte de ganga para que este tenga una mejor concentración. Esta operación de concentración se realiza mediante métodos de flotación y separación magnética.
Extraccion del metal:
A continuación, se explicará brevemente las principales operaciones que se utilizan en el proceso de extracción del metal por pirometalurgia. No es necesario utilizar todas las operaciones en esta etapa.
- Calcinación: Tiene como objetivo principal descomponer un compuesto en sus óxidos formadores mediante el uso del calor.
- Tostación: Operación mediante el cual reaccionan un sulfuro y oxigeno del aire, obteniéndose un oxido. Por ejemplo, la tostación de los minerales sulfurados de cobre para producir óxido de cobre.
Proceso Electrometalúrgico: Es un proceso en el cual se utiliza energía eléctrica para la purificación de los minerales que aún poseen impurezas. Es uno de los últimos procesos que se le aplica al metal para obtener un mejor resultado, siendo uno de los procesos necesarios para la obtención de algún metal en específico. Asimismo, otra de las aplicaciones importantes de este proceso de refinamiento es la recuperación de impurezas valiosas, como por ejemplo la plata y el oro contenidas en el cobre.
Dentro de este proceso de extracción existen diferentes técnicas como la electroobtención y la electrorefinación, las cuales son utilizadas para la extracción de metales bajo diferentes condiciones.
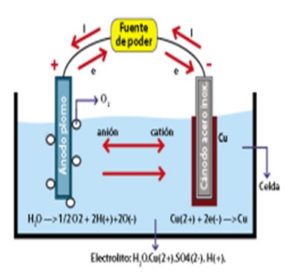
Electroobtención: Cuando dos electrodos se conectan a una fuente de voltaje y se sumergen en una disolución que contiene iones, los iones positivos emigran al electrodo que tiene el exceso de electrones (cátodo), los iones negativos emigran hacia el electrodo deficiente de electrones (ánodo), como se muestra en la foto (Cortés Ruiz y Guillen:2010)
- Fusión: Operación en la cual, mediante el uso de un horno adecuado, se obtienen varias fases fundidas: el metal y la escoria. Por ejemplo, se usa para extraer el hierro, lo que se conoce como fusión reductora. Es una de las operaciones mas utilizadas en la metalurgia.
Afino: EL objetivo de esta etapa es separar el metal principal de otros elementos, los cuales son las impurezas. Las principales operaciones de purificación son las siguientes: Electrolisis en disolución acuosa, descomposición térmica y fusión por zonas.
Como ejemplos de procesamiento de materiales metálicos por pirometalurgia tenemos la pirometalurgia del hierro, acero y cobre.
Gráfico de Electroobtención (Cortés Ruiz y Guillen:2010)
Electrorefinición: Con frecuencia, un metal se transfiere desde un ánodo impuro o desde una aleación o compuesto hacia un compuesto hacia un cátodo hecho de un metal puro. Por ejemplo, en la refinación del cobre, dos electrodos de cobre se encuentran sumergidos en una disolución de CuSO4. Entonces, el proceso de electrorefinación del cobre consiste en la transferencia de un mol de cobre desde el ánodo impuro hasta el cátodo. (Cortés Ruiz y Guillen:2010)
Gráfico de Electrorefinación (Cortés Ruiz y Guillen:2010)
- Reactividad de los metales:
La reactividad es una propiedad de los elementos que tiene una relación muy estrecha con la colocación de los mismos en la tabla periódica, esta situación esta relacionada con la configuración electrónica de los elementos. Los elementos tienen tendencia a parecerse a los gases nobles más cercanos en cuanto a su configuración electrónica de la última capa. Por ese motivo se dice que la reactividad de un elemento químico es la tendencia que dicho elemento posee a combinarse con otros. Para los metales esta tendencia es directamente proporcional a la facilidad con la que pierden sus electrones de valencia. Cuanto menor sea la energía de ionización del metal, mayor será su reactividad.
Si analizamos la variación de la energía de ionización en un mismo grupo del sistema periódico, vemos que, al descender en éste, el número cuántico principal de los orbitales de valencia es mayor, con lo cual, el tamaño de dichos orbitales será mayor. Los electrones que se encuentran en dichos orbitales están más alejados del núcleo por lo que son menos atraídos por éste. Así, se necesita cada vez menos energía para arrancar estos electrones de valencia según descendemos en el grupo. Este descenso en la energía de ionización hace aumentar la reactividad de los elementos situados más abajo en un grupo.
IMPLICANCIAS DEL DESCUBRIMIENTO DE UN YACIMIENTO DE LITIO EN PERU
En el mes de Julio del presente año, la compañía canadiense Macusani Yellowcake informó de lo que podría ser el hallazgo del yacimiento de litio más grande del mundo, al detallar que se descubrieron recursos probados de litio por aproximadamente 2.5 millones de toneladas, así como 124 millones de libras de uranio en el depósito Falchani en Puno (El Comercio 2018: s/p). Es importante señalar también que el yacimiento es considerado como de alta ley, pues esta oscila entre 3500 y 4000 ppm, a diferencia de los yacimientos de Chile y Bolivia, que poseen una ley promedio de 500 ppm (El Comercio 2018: s/p).
Esta es una noticia que no solo ha causado gran revuelo en el país, sino que ha trascendido las fronteras para ser cubierta por medios de todo el mundo, principalmente, como era de esperarse, en Bolivia y Chile, ante todo esto, cabe preguntarse ¿Por qué resulta tan importante este descubrimiento?, o más específicamente ¿Cuál es la importancia de este hallazgo?
La respuesta a las interrogantes planteadas radica principalmente en dos factores, el primero se refiere a la naturaleza del yacimiento, es decir a la ley de este. Tal cual se mencionó en el primer párrafo, la ley del hallazgo en Puno es 7 u 8 veces mayor a la de los yacimientos de Chile y Bolivia, y esto principalmente porque el litio de estos países de encuentran mayoritariamente en salares, mientras que los yacimientos peruanos corresponden a rocas(Diario Gestión 2018: s/p). El segundo factor que realza la relevancia de este descubrimiento es la creciente demanda de litio para la producción de vehículos eléctricos. El litio constituye el componente principal para las baterías de la mayoría de dispositivos eléctricos; sin embargo, en el futuro la mayor demanda provendrá del mercado de autos eléctricos. Esto trae consigo un incremento en la exploración y búsqueda de yacimientos en todo el mundo (HYE 2018: s/p), haciéndose cada vez más común el uso de tecnologías avanzadas que permitan acercarnos cada vez más a yacimientos o zonas en donde hace algunas décadas era imposible seguir con la exploración, en ese sentido, opinamos que el Perú no debe quedarse atrás en el fomento de la inversión para la exploración minera en nuestro territorio, así como en el desarrollo del marco legislativo necesario para la explotación responsable del litio y uranio, puesto que actualmente el Perú no cuenta con leyes dirigidas a la explotación de minerales no metálicos, aunque debido a los últimos hallazgos, ya se empiezan a observar esfuerzos por parte del gobierno para poder viabilizar los proyectos.
Producción global de litio por año (HYE 2018: s/p)
Principales procesos para el aprovechamiento del litio:
Las reacciones químicas de reducción-oxidación (redox) controladas mediante ánodos y cátodos son el punto de partida de los elementos destinados al almacenamiento de energía, es decir, a las baterías actuales de muchos dispositivos, así, dependiendo de si es que se busca que el dispositivo consuma o suministre energía, el cátodo será negativo y el ánodo positivo para el primer caso, o el cátodo será positivo y el ánodo negativo para el segundo caso respectivamente. Bajo este concepto, a lo largo de la historia se han ido presentado diversos tipos de baterías con distintos rendimientos, siempre en la búsqueda de poder alcanzar una mayor densidad de energía con dispositivos más pequeños, así, actualmente una de las baterías más difundidas es la de ion-litio (Manrique 2014: 53).
“Cada celda electroquímica dispone de un electrodo negativo y uno positivo, conectados en forma interna por un electrolito que lleva los iones entre ambos y la corriente eléctrica generada se transporta externamente.” (Manrique 2014: 53).
Aplicaciones del Litio:
- Hidróxido de litio como grasa lubricante de uso industrial y automotriz.
- Baterías de ion-litio y polímero de litio como fuente de energía para dispositivos móviles, computadoras portátiles y vehículos eléctricos.
- Carbonato de litio como principal componente para la fabricación de vidrio cerámico (SQM 2018: s/p).
Bibliografía:
DIARIO GESTIÓN (2018). El futuro del litio en el Perú: no solo en salares, también en las rocas”. Diario Gestión. Lima, 14 de setiembre.
https://gestion.pe/economia/futuro-litio-peru-salares-rocas-244408
El Comercio (2018)“Descubren 2,5 millones de toneladas de litio en Puno | Minería”. El Comercio. Lima, 17 de julio.
HÍBRIDOS Y ELÉCTRICOS . La producción mundial de litio se triplicará en los próximos cuatro años.
MANRIQUE, Alejandro (2014). Explotación del litio, producción y comercialización de baterías de litio en Argentina. Trabajo Final Integrador de la carrera de postgrado “Especialización en Gestión de la Tecnología y la Innovación”. Argentina.
SQM (2018, 24 de abril) Los principales usos del Litio son en baterías, vidrio cerámico, grasas lubricantes, aire acondicionado, entre otros.
https://www.sqm.com/estudio/aplicaciones-de-litio/
Reactividad. Consulta: 10 de noviembre de 2018
https://www.ecured.cu/Reactividad
ESCUELAPEDIA
Reactividad de los metales. Consulta: 10 de noviembre de 2018
http://www.escuelapedia.com/reactividad-de-los-metales/
Brown, T. (2004). Química. La ciencia central. México: Pearson Educación de México, S.A.
Chang, R. y Goldsby, K. (2013). Química. México: McGraw-Hill/Interamericana Editores, S.A.
Portero, M. J. M. (2016). Extracción de metales por pirometalurgia: Procesamiento de hierro, acero, cobre y aluminio
CORTEZ RUIZ, José y otros
2010 “Procesos de obtención de materiales”. Material del curso de Química III. Ciudad de México. Universidad Nacional Autónoma de México, Consulta: 09de noviembre de 2018.
http://www.perusolar.org/wp-content/uploads/2016/07/Sistema-de-Calefaccion-Solar-Ciro-Espinoza.pdf