Trabajo presentado por el Equipo 5: Futuros ingenieros, El Tri, Los halógenos
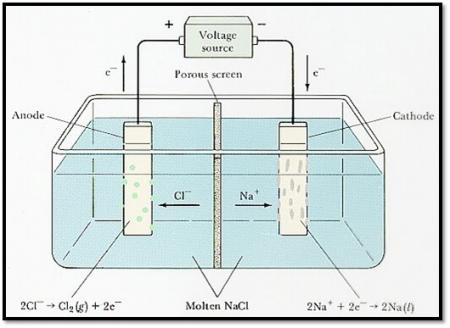
CELDA ELECTROLÍTICA
Fuente: http://quimica4m.blogspot.com/2010/01/celdas-electroliticas.html, consulta 5 junio 2014
CONCEPTOS CLAVE
1. ASPECTOS CUANTITATIVOS DE LA ELECTRÓLISIS:
La estequiometria de una media-reacción muestra cuántos electrones se requieren para lograr un proceso electrolítico. Por ejemplo, la reducción del Na+ a Na es un proceso de un electrón:
De esta manera, 1 mol de electrones deposita 1 mol de Na metálico, 2 moles de electrones depositan 2 moles de Na metálico, y así sucesivamente. De manera similar, son necesarios 2 moles de electrones para producir 1 mol de cobre a partir de Cu2+, y son necesarios 3 moles de electrones para producir 1 mol de aluminio a partir de Al3+.
Cu2+ + 2 e- —–► Cu
Al3+ + 3 e- —–► Al
Para cualquier media-reacción, la cantidad de una sustancia que se reduce o se oxida en una celda electrolítica es directamente proporcional al número de electrones que se introducen en la celda.
Por lo general, la cantidad de carga que pasa a través de un circuito eléctrico,como el de una celda electrolítica, se mide en coulomb. Como se mencionó en la sección 2 0 5 , la carga de 1 mol d e electrones es 96,485 C (1 faraday). Un coulomb es la cantidad de carga que pasa por un punto en un circuito en 1 s cuando la corriente es de 1 ampere (A). Por lo tanto, se puede obtener el número de coulomb que pasa a través de una celda al multiplicar al amperaje y el tiempo transcurrido en segundos.
Coulombs = amperes.segundos
CONSULTA 5 DE JUNIO DEL 2014 http://rephip.unr.edu.ar/bitstream/handle/2133/3265/8001-14%20Olimp%C3%ADadas%20de%20Qu%C3%ADmica%20-%20Nivel%20I.pdf?sequence=1
2. ELECTRÓLISIS DEL AGUA
El agua H2O, por medio de la energía suministrada por una batería, se puede disociar en moléculas diatómicas de hidrógeno (H2) y oxígeno (O2).Este proceso es un buen ejemplo de la aplicación de los cuatro potenciales termodinámicos.
La electrólisis de una mol de agua, produce una mol de gas hidrógeno y media mol de gas oxígeno en sus formas normales diatómicas .Un detallado análisis del proceso, muestra el uso de los potenciales termodinámicos y la primera ley de la termodinámica.
BROYVN, THEODORE L, cois. Química la ciencia central, decimoprimera edición. PEARSON EDUCACIÓN, México, 2009
3. CELDAS ELECTROLÍTICAS:
Una celda electrolítica consta de dos electrodos en una disolución o una sal fundida. Una batería o alguna otra fuente de corriente eléctrica directa actúa como una bomba de electrones, cediendo los electrones hada un electrodo y aceptándolos desde el otro. Al igual que en las celdas voltaicas, el electrodo en el cual se efectúa la reducción se llama el cátodo, y el electrodo en el cual efectúa la oxidación se llama ánodo.
http://hyperphysics.phy-astr.gsu.edu/hbasees/thermo/electrol.html
CONSULTA 6 DE JUNIO DEL 2014
4. ELECTRÓLISIS:
La electrolisis es un proceso mediante el cual se logra la disociación de una sustancia llamada electrolito, en sus iones constituyentes (aniones y cationes), gracias a la administración de corriente eléctrica.
Básicamente hay dos tipos de electrolitos, los llamados fuertes y débiles. Los utilizados en la electrolisis son los electrolitos fuertes. Esta familia está formada por todas las sales, ácidos fuertes e hidróxidos fuertes. Como bases fuertes podemos citar a las de los metales alcalinos y alcalino térreos como los hidróxidos de Sodio, Potasio, Calcio y Magnesio. Como ejemplos de ácidos fuertes tenemos al ácido clorhídrico, sulfúrico, nítrico y perclórico.
Este proceso se tiene que llevar a cabo en un aparato llamado cuba o celda electrolítica. Está formada por dos electrodos de un metal inerte, por ejemplo Platino o Paladio. Conectados a una fuente de energía eléctrica o FEM. El circuito lo cierra justamente la sustancia que se va a disociar en iones, el electrolito. En algunos casos, cada electrodo se ubica en un vaso distinto por separado. Cuando esto sucede se usa un puente salino que los conecta. Es una especie de tubo en U con una sustancia iónica como una sal que permite el flujo constante de cargas.
http://www.quimicayalgomas.com/quimica-general/electrolisis-y-pilas/
CONSULTA 6 DE JUNIO DEL 2014
5. CORROSIÓN ELECTROQUÍMICA
La corrosión electroquímica es un proceso espontáneo que denota siempre la existencia de una zona anódica (la que sufre la corrosión), una zona catódica y un electrolito, y es imprescindible la existencia de estos tres elementos, además de una buena unión eléctrica entre ánodos y cátodos, para que este tipo de corrosión pueda tener lugar. La corrosión más frecuente siempre es de naturaleza electroquímica y resulta de la formación sobre la superficie metálica de multitud de zonas anódicas y catódicas; el electrolito es, en caso de no estar sumergido o enterrado el metal, el agua condensada de la atmósfera, para lo que la humedad relativa deberá ser del 70%.
El proceso de disolución de un metal en un ácido es igualmente un proceso electroquímico. La infinidad de burbujas que aparecen sobre la superficie metálica revela la existencia de infinitos cátodos, mientras que en los ánodos se va disolviendo el metal. A simple vista es imposible distinguir entre una zona anódica y una catódica, dada la naturaleza microscópica de las mismas (micropilas galvánicas). Al cambiar continuamente de posición las zonas anódicas y catódicas, llega un momento en que el metal se disuelve totalmente.
CONSULTA 5 DE JUNIODEL 2014
http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen2/ciencia3/079/htm/sec_6.htm
6. CELDA GALVANICA
La celda galvánica o celda voltaica, denominada en honor de Luigi Galvani y Alessandro Volta respectivamente, es una celda electroquímica que obtiene la energía eléctrica a partir de reacciones redox espontáneas que tienen lugar dentro de la misma. Por lo general, consta de dos metales diferentes conectados por un puente salino, o semi-celdas individuales separados por una membrana porosa. Volta fue el inventor de la pila voltaica, la primera pila eléctrica. En el uso común, la palabra pila es una celda galvánica única y una batería propiamente dicha consta de varias celdas, conectadas en serie o paralelo
CONSULTA 5 DE JUNIO DEL 2014
Cathodic Protection 101. A basic tutorial on galvanic cells and corrosion prevention.
APLICACIONES
La utilización de CELDAS ELECTROLITICAS como equipos en el tratamiento de aguas residuales se extiende a numerosas aplicaciones de recuperación de metal por medio de la electrodeposición en el cátodo y rotura de complejos presentes en las aguas.
La aplicación de sistemas de recuperación de metales por celdas electrolíticas implica una serie de ventajas evidentes:
- Posibilidad de realizar dobles reacciones químicas (Ej. CuCN)
- Ahorro en el consumo de reactivos químicos
- Ahorro en Gestión de Lodos
- Bajo coste Energético
- Mantenimiento mínimo de los equipos
Equipos aplicados a distintos sectores:
- Galvanotecnia : Electrodeposición de metales en el cátodo.Oxidación anódica de cianuro.
- Farmacia : Rotura de complejos.
- Minería /Química : Recuperación de metales preciosos.
- Sector de tintes : Eliminación de color.