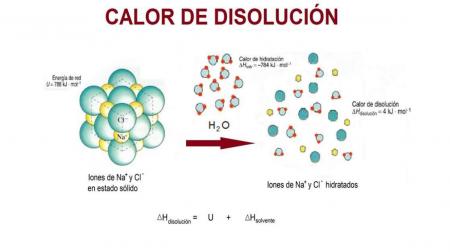
El calor de disolución se da por la separación de iones dentro de un solvente. Está estrechamente relacionado con la energía de celda y con la entalpia de hidratación.
Listado de conceptos claves
1. Entalpía o calor de reacción: Cantidad que define la relación H = E- PV; el cambio de entalpía, ΔH, para una reacción que tiene lugar a presión constante es el calor que se desprende o se absorbe en la reacción: ΔH= qp.
Brown T., LeMay H. y Bursten B. (1998). Química la ciencia central 7ª edición. México: Prentice Hall Hispanoamericana S.A.
2. Soluto: Sustancia disuelta en un disolvente para formar una solución; normalmente es el componente de una solución que está presente en menor cantidad.
Brown T., LeMay H. y Bursten B. (1998). Química la ciencia central 7ª edición. México: Prentice Hall Hispanoamericana S.A.
3. Disolvente: Es el medio disolvente de una solución; normalmente es el componente de una solución presente en mayor cantidad.
Zaragoza, E. d. (1995). Disolventes en la Industria Química. Zaragoza.
4. Calor de disolución: Es la variación de entalpía relacionada con la adición de una cantidad determinada de soluto a una cantidad determinada de solvente a temperatura y presión constantes.
Castellan, G. W. (1987). Fisicoquímica. En G. W. Castellan, Fisicoquímica (pág. 144).
5. Energía reticular: La energía requerida para separar completamente un mol de un compuesto sólido iónico en sus iones en estado gaseoso se llama energía reticular o de red (U).
Chang R. (2010) Química Décima edición (pp. 259). México: McGraw Hill.
6. Energía de hidratación: Es un nombre especial para la energía de solvatación cuando el disolvente es el agua. En otras palabras, la energía de hidratación, es el cambio de energía cuando los iones en estado gaseoso se disuelven en agua.
Martínez-Álvarez R., Rodríguez J. y Sánchez M. (2007) Química: un proyecto de la American Chemical Society. En Müller G. y Llano M. (Eds.) Soluciones acuosas y solubilidad (pp. 72-153). España: Editorial Reverté
7. Ley de Hess: Es un principio propuesto por el químico German Henry Hess, quien dijo: “La variación de Entalpía en una reacción química va ser la misma si esta se produce en una sola etapa o en varias etapas”. Es decir, que la variación de entalpía de la reacción se puede hallar si se conoce la variación de entalpía de cada proceso que resulta en la variación de entalpía de la reacción química principal.
Arroyo P. (2014, 14 de mayo). Bases de Química General. Fecha de consulta: 14 de septiembre del 2014 de: http://www.quimicayalgomas.com/quimica-general/termoquimica-y-termodinamica/termoquimica-ley-de-hess/
8. Calorímetro: Es un instrumento de laboratorio conformado por un frasco que contiene el sistema rodeado por agua, un termómetro y un agitador en un sistema aislado. Se usa para calcular el valor de la variación de calor durante un proceso.
Picado A., Álvarez M. (2008) Química I: Introducción al estudio de la materia. (pp.414). Costa Rica: EUNED
Aplicación: Uso del nitrato de amonio
El calor de disolución es un proceso que se da en la separación de iones de una sustancia dentro del agua. Este proceso se basa en la separación de iones a una distancia infinita dentro de una red cristalina producida por la presencia de cargas. El agua posee una carga positiva parcial por el lado del hidrogeno, mientras que por el lado del oxígeno tiene una carga parcial negativa. Al disolverse cualquier sustancia iónica se produce una absorción o liberación de energía. La energía de disolución se compone de una energía de red y una de hidratación:
Para el nitrato de amonio se tienen los siguientes datos: U0 (NH4NO3) = 676 kJ/mol DH hidr (NO3-) = – 401 kJ/mol DH hidr (NH4+) = – 301 kJ/mol De los datos se puede calcular el valor de la entalpia de disolución y se observa que el valor aproximado es de 26 Kj/mol. El proceso de disolución del nitrato de amonio es un proceso endotérmico, por lo tanto absorbe el calor de los alrededores disminuyendo la temperatura del entorno. Esta absorción de calor es usada convenientemente para poder bajar la temperatura de manera instantánea ya que la velocidad de reacción es favorable. Esta energía de disolución se aplica en los paquetes fríos que usan los deportistas al sufrir una herida o hinchazón.
Dentro de estos paquetes poseen una determinada cantidad de nitrato de amonio que al disolverse en el agua y absorber la temperatura del entorno disminuyen la temperatura del agua hasta -5 C°, por debajo de su punto de fusión. Esta disminución de temperatura es favorable ya que evita que el hinchazón se inflame ya que si se disminuye la temperatura también disminuirá el volumen del hinchazón producido por el golpe.
CRECES (Revista).El calor y el frio en las reacciones químicas. Recuperado el 9 de setiembre del 2014, de: http://www.creces.cl/new/index.asp?imat=++%3E++13&tc=3&nc=5&art=1176
