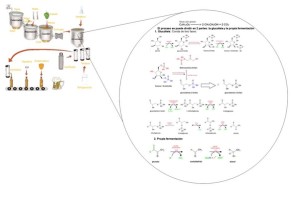
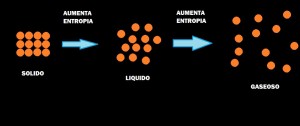
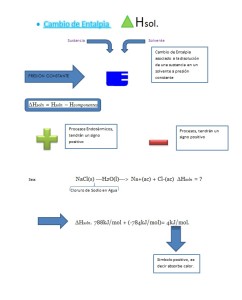
PROCESO DE OBTENCIÓN DE LA CERVEZA
Equipo 2 (H-205): Team, Mad Science, REKA
Imagen hecha a partir de superposición de imágenes. Imagen hecha a partir de otra.
– Cervecería Jagger
2011 “El proceso de elaboración”. Consulta: 02 de noviembre de 2015
http://cerveceriajagger.com.ar/wordpress/tag/elaboracion/
A continuación se dará una breve explicación de cada proceso enfocándonos en el proceso de fermentación.
Maceración de la malta: proceso en el cual se introducen los ingredientes necesarios para la obtención del mosto.
Cocción: en esta etapa se introduce la malta previamente filtrada para luego ser hervida junto con el lúpulo.
Fermentación: en las fases anteriores el mosto se quedó en forma de almidón y azucares. Es en el proceso de fermentación en el cual se obtiene el “OH” y el “CO2”.
Este proceso sucede en dos etapas:
La glucolisis: proceso en el cual se oxida la glucosa (esta se encuentra en el almidón) para luego obtener moléculas de piruvato.
La fermentación: en este proceso se reduce el piruvato previamente obtenido en el proceso de glucolisis para finalmente convertirse en etanol.(es aquí donde logra su obtener el “OH” necesario para que sea contenida bebida alcohólica.).
Finalmente el proceso de manufactura en el cual involucran todos los procesos mecánicos, como embotellamiento, etiquetamiento, etc.
En el proceso de elaboración de la cerveza son 2 las etapas más importantes: Glucólisis y Fermentación.
Por lo planteado en la imagen, se observa que de los distintos procesos por el que se pasa para la elaboración de la cerveza el más importante es la fermentación.
En la glucólisis, la sustancia que reacciona es la glucosa con el oxígeno para formar agua y dióxido de carbono. En la cual no presenta equilibrio molecular.
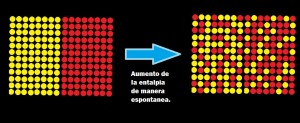
El equilibrio molecular es muy usado en la industria cervecera, sobre todo en la etapa de fermentación. Ya que sirve para determinar el tiempo y la velocidad de esta. Los cuales son de mucha importancia en la calidad de la cerveza.
La fermentación transforma el piruvato en etanol, después de eliminar una molécula de dióxido de carbono (descarboxilación). Es característica de muchas levaduras
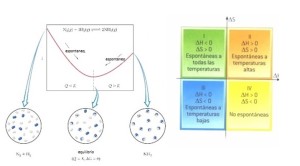
El equilibrio químico se alcanza solo en las reacciones reversibles, se logra cuando ambas reacciones (directa e inversa) se llevan a cabo a la misma velocidad y continúan realizándose en el tiempo. De esta manera los productos se forman a la misma velocidad en la que se consumen. Y las concentraciones de productos y reactantes permaneces constante en el tiempo.
Bibliografía
- BRASIL ESCOLA.
Equilibrio químico-Equilibrio molecular. Consulta: 2 de noviembre del 2015. https://translate.google.com.pe/translate?hl=es&sl=pt&u=http://www.brasilescola.com/quimica/equilibrio-molecular.htm&prev=search
– QUIMITUBE
“Equilibrio Químico”. Consulta: 03 de noviembre del 2015.
http://www.quimitube.com/
-ALDA, Francisco Luis
2010 “Glucólisis y fermentación”. Consulta: el 3 de noviembre del 2015
http://b-log-ia20.blogspot.pe/2010/02/glucolisis-y-fermentacion.html