Conceptos Claves
1.- Procesos Espontáneos:
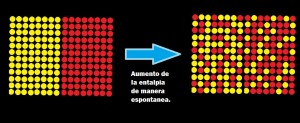
Se dice que un proceso es espontáneo si ocurre por cuenta propia sin intervención alguna del exterior; es decir, ocurre por sí mismo en un sentido definido a ciertas condiciones como la temperatura y la presión
Brown, Theodore (2009). QUÍMICA la Ciencia Central (pp. 802). México: Person educación
2.- Entropía:
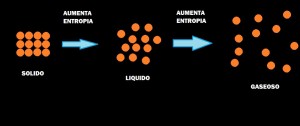
Es la medida del grado de dispersión de la energía en un sistema entre las diferentes posibilidades en que ese sistema puede contenerla. A mayor dispersión mayor entropía. La mayoría de procesos está acompañado por un cambio de entropía. Las unidades de entropía son J/K o J/K por 1 mol de sustancia1. Es una característica del estado de un sistema2.
1Chang, Raymond (2013). QUÍMICA 11° edición (pp. 780). México: Mc Graw Hill Education
2Brown, Theodore (2009). QUÍMICA la Ciencia Central (pp. 806). México: Person educación
3.- Entropía estándar de reacción:
Cambio de entropía cuando la reacción se lleva a cabo en condiciones estándar; es decir, es la entropía absoluta de una sustancia a 1 atm. Y 25°C
Chang, Raymond (2013). QUÍMICA 11° edición (pp. 784). México: Mc Graw Hill Education
4.- Cambio de entropía:
Es una función de estado como la energía interna y la entalpía, por lo tanto, el cambio de entropía de un sistema depende solo de los estados inicial y final del sistema y no de la trayectoria que se siguió para pasar de un estado a otro.
Brown, Theodore (2009). QUÍMICA la Ciencia Central (pp. 806). México: Person educación
5.- Movimientos moleculares:
Cuando una sustancia se calienta el movimiento de las moléculas aumenta. Las moléculas pueden presentar tres tipos de movimientos. La molécula completa puede moverse en un sentido, como los movimientos de las partículas de un gas ideal. A estos movimientos le llamamos movimientos de traslación. Las moléculas de un gas tienen más libertad de movimiento que las de un líquido, las cuales a su vez tienen mayor libertad de traslación que las moléculas de un sólido. Una molécula también puede experimentar movimiento traslatorio en el que los átomos de las moléculas se mueven periódicamente acercándose y alejándose. Otro tipo de movimiento es el de la rotación como si estuviese girando como trompo. Estas formas diferentes de movimientos son formas en las que una molécula puede almacenar energía y nos referimos a ellas de forma colectiva como energía de movimiento de la molécula.
Brown, Theodore (2009). QUÍMICA la Ciencia Central (pp. 809-810). México: Person educación
6.- Segunda ley de termodinámica:
La entropía del universo aumenta en un proceso espontaneo y se mantiene constante en un proceso que se mantiene en equilibrio.
Brown, Theodore (2009). QUÍMICA la Ciencia Central (pp. 785). México: Person educación
7.- La tercera ley de termodinámica:
La entropía de una sustancia cristalina es cero a la temperatura de cero absoluto. A medida que la temperatura aumente la libertad de movimiento se incrementará; es decir, la entropía aumenta de forma gradual como consecuencia del mayor movimiento molecular.
Brown, Theodore (2009). QUÍMICA la Ciencia Central (pp. 789). México: Person educación
8.- Entropía absoluta:
Es la entropía de la sustancia a 298K. Este es el valor verdadero y no un valor derivado
Brown, Theodore (2009). QUÍMICA la Ciencia Central (pp. 790). México: Person educación
- Aplicación:
En el caso de entropía y espontaneidad.
Describiré el proceso de funcionamiento de un motor petrolero ( automóvil diésel ) , para esto debemos de conocer el funcionamiento de un cigüeñal con los pistones (cilindros) a estos pistones , que tienen esa forma de cilindro , una vez que entra el aire y el petróleo a presión atmosférica el volumen aumenta , una vez que se juntan el aire y el petróleo – estos combustionan sin necesidad de un factor externo como la chispa – se comprime adiabáticamente el volumen , y la temperatura aumenta . Realizándose así un alto grado de entropía. Durante este tiempo la presión y la temperatura aumentan rápidamente, aunque el volumen permanece constante, liberando energía para que así junto a los demás pistones comiencen a moverse haciendo la misma función que es la de liberar energía y poder iniciar el movimiento del automóvil. Este proceso es irreversible, pero no espontaneo.
Prof. López Ávila. Maquinas termodinámicas y La segunda ley de la Termodinámica
Física II comision2k1/2s1 http://apuntescientificos.org/segunda-ley-qbp.html
Un caso que es Espontaneo es en el caso que en cierta parte alta de un cerro haya un molino de agua donde el calor descienda de esta fuente que se encuentra a temperatura elevada, hacia una fuente de temperatura fría que podría ser un sumidero, generando trabajo durante su paso. Este proceso es irreversible.
Dra. Sofía Arellanos Cárdenas, Dra. Socorro López Cortez, Dra. Lucía Ramírez Torres e Ing. Juan Carlos Mares Gutiérrez.
Miembros de la academia de Fisicoquímica del departamento de Biofísica de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional de México.
http://apuntescientificos.org/segunda-ley-qbp.html