CONCEPTOS CLAVE
Entropía:
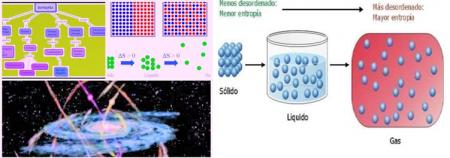
La entropía es representada con la letra S y mide en forma directa el grado de desorden de un sistema. L a entropía es una función de estado, ya que solo va a depender las condiciones iniciales y finales, también observamos que es una propiedad extensiva porque depende de la cantidad de materia. Podemos ordenarlo de esta manera:
Ssólido < Slíquido < Sgas
Si aumenta el desorden: Sf > SI à S > 0
PARA UN PROCESO ESPONTÁNEO:
ΔS = Sfinal – Sinicial
Y tenemos que:
ΔS > 0 Aumento del desorden
ΔS < 0 Disminución del desorden
En un sistema aislado y a volumen constante (que no puede intercambiar ni materia ni energía con el entorno) se dará espontáneamente aquel proceso en el que se produzca un aumento de la entropía, esto es, aquel proceso en el que aumente el desorden. Es decir, en general, los sistemas tienden a un aumento del desorden. Es por este motivo que existen reacciones endotérmicas que son espontáneas; reacciones que por criterios energéticos pareciera que no deben producirse espontáneamente y que, sin embargo, sí ocurren de este modo, porque en el transcurso de las mismas la entropía aumenta considerablemente.
Entropía estándar:
La entropía es una medida del grado de dispersión de la energía en un sistema entre las diferentes posibilidades en que ese sistema puede contenerla. A mayor dispersión, mayor entropía. La entropía estándar viene a ser la entropía absoluta de una sustancia a 1atm y 25°C.
Segunda ley de la termodinámica:
La entropía del universo aumenta en un proceso espontáneo y se mantiene constante en un proceso que se encuentra en equilibro.
ΔSuniv = ΔSsist + ΔSent ≥ 0
Tercera ley de la termodinámica:
La entropía de una sustancia cristalina perfecta es cero a la temperatura del cero absoluto.
S° (0 K) = 0
Espontaneidad de las reacciones químicas
En el mundo y la naturaleza existen muchos procesos químicos pueden ser procesos físicos como también reacciones químicas. Un proceso espontáneo es aquel que sucede sin necesidad que haya un aporte energético; como por ejemplo, una pelota que este rodando a lo largo de una pendiente, pues está no se detendrá hasta que no llegue a una zona llana y pierda su energía cinética. Asimismo, una reacción espontánea química es aquella cuando una vez inicia la reacción transcurre completamente cuando todos los reactivos se han transformado en productos.
Los procesos espontáneos son irreversibles, ya que no se pueden revertir a menos que tengas un aporte energético externo.
Podríamos pensar que una reacción exotérmica, que desprende calor al entorno, siempre será espontánea, dado que los sistemas tienden a un mínimo de energía, y en las reacciones exotérmicas los productos tienen menos energía que los reactivos (tal y como vemos en el diagrama). Es cierto que muchas reacciones espontáneas son exotérmicas y que la mayoría de reacciones exotérmicas son espontáneas; sin embargo, esto no es siempre así. Existen reacciones exotérmicas que no son espontáneas a ciertas temperaturas, y reacciones endotérmicas que sí lo son.
Por tanto, el criterio energético, es decir, el signo de la variación de entalpía ΔH, no es suficiente por sí mismo para decidir si un proceso será o no espontáneo, ya que en verdad, si consideramos el conjunto sistema-entorno, la energía siempre se conserva.
Concepto de equilibrio en la reacciones químicas:
Las reacciones químicas no tienen lugar siempre a la misma velocidad, ni se alcanza siempre a una misma transformación completa de los reactivos en productos.
Si por ejemplo analizamos esta reacción:
aA+bB → cC+dD
en la que inicialmente solo tenemos reactivos A y B , veremos que las moléculas de Ao B son muy numerosas y chocan entre sí rompiéndose los enlaces que la forman, liberando átomos y formándose nuevos en laces entre ellos, dando lugar a las sustancias producto C y D, produciéndose la reacción inversa .A medida que la reacción va progresando puede que la reacción regrese a su estado inicial a esto se le llamaría reacción inversa. Por lo tanto, llega un momento en que las velocidades de reacción en ambos sentidos se igualan. El número de moléculas de cualquier especie permanece constante y por lo tanto también permaneces constante la concentración de las mismas. Se dice entonces que la reacción ha alcanzado un estado de equilibrio químico.
Se ha visto el tema de termoquímica que la función de estado energía libre se definía como: G=HTS , y que dicha función medía la energía libre de cada reactivo o producto de la reacción química, de forma que podía calcularse la variación de energía libre de una reacción mediante la expresión : ΔG=ΔH-TΔS.
Puede demostrarse que para una reacción homogénea gaseosa existe una relación entre el valor de ΔG y el valor de la constante de equilibrio Kp, dada la ecuación:
ΔG= -RTlnKp
Esto indica que las reacciones espontáneas (ΔG<0), presentan constantes de equilibrio mayores que la unidad, y por lo tanto, el equilibrio está muy desplazado hacia la derecha, es decir hacia la formación de productos.
En las reacciones espontáneas (ΔG>0), tienen constantes de equilibrio muy pequeñas, tanto menores cuanto más positivas sea la variación de energía libre, y por tanto el equilibrio estará muy desplazado hacia los reactivos, de forma que se producirán bajas concentraciones de productos.
Aplicación:
AGUJEROS NEGROS:
La formación de los agujeros negros, producto del colapso de una estrella, es un claro ejemplo de un proceso espontaneo ya que en él no interviene ninguna fuerza ajena a la naturaleza, además resulta inverosímil pensar que puede ocurrir el proceso contrario de manera natural, es decir que a partir de un agujero negro se forme una estrella.

En un principio se pensó que la segunda ley de la termodinámica no se aplicaba a los agujeros negros, sin embargo los trabajos de Jacob D. Bekenstein sugirieron que podría conservarse la ley siempre y cuando se introdujera el concepto de “ENTROPIA GENERALIZADA” que se calcula a través de la entropía dada por la segunda ley y una formula dada en función del área del agujero negro, desarrollada por Stephen Hawking. Este concepto se introdujo debido a la complejidad de
la configuración interna de los agujeros negros y a nuestra falta de información respecto a lo que pasa dentro de este, aunque se cree que mayormente se mantiene a temperatura constante. Si tenemos cierto sistema con algún valor de entropía S que traspasa el horizonte de eventos de un agujero negro, la entropía asociada con el universo visible disminuiría. Sin embargo el crecimiento del área del agujero negro compensa la entropía perdida debido a la desaparición del sistema, de una manera irreversible
Al formarse un agujero negro, este tendera a estabilizarse aun si después o durante su creación se le adiciona materia, en esta fase su área disminuye, sin embargo una vez pasado esto tendera a aumentar de tamaño al tiempo que consume materia, por ello su entropía aumentara(proporcional al área).
BIBLIOGRAFIA:
http://bibliotecadigital.ilce.edu.mx/sites/ciencia/volumen1/ciencia2/50/html/sec_8.html
imágenes:
http://tarazfisicaquimica.blogspot.com/2012/01/termoquimica-parte-ii.html?m=1
[9/15 10:13] Raul: http://cynverbd.wordpress.com/2011/05/11/entropia/ [9/15 10:16]
Raul: http://quercusprevencionderiesgoslaborales.blogspot.com/2012/08/ciencia-entropia-segunda-ley-de-la.html?m=1 [9/15 10:17]
Raul: http://alquimiayciencias.blogspot.com/2012/08/el-misterio-de-la-entropia.html?m=1 [9/15 10:18]
Raul: http://e-ducativa.catedu.es/44700165/aula/archivos/repositorio/4750/4848/html/2_la_entropa.html
Fuente:
MASTERTON, WILLIAM L.; HURLEY, CECILE
2003 QUIMICA: Principios y reacciones. 4ta ed. Madrid: Thomson Learning; Paraninfo.
CHANG, R.
2007 Química. Novena edición. México D.F.: McGraw-Hill. Pág. 784
CHANG, R.
2007 Química. Novena edición. México D.F.: McGraw-Hill. Pág. 785
CHANG, R.
2007 Química. Novena edición. México D.F.: McGraw-Hill. Pág. 789
Química2° Bachillerato
Bloque VII: Equilibrio químico
http://www.ieslaaldea.com/documentos/fisicayquimica/equilibrioquimico.pdf
