(2013) Extinción de Dinosaurios: La Tierra en llamas. Recuperado el 12 de setiembre del 2014, de:
http://www.taringa.net/posts/info/16578928/Extincion-de-Dinosaurios-La-Tierra-en-llamas.html.
(2012) Tetraedro del fuego. Recuperado el 12 de setiembre del 2014, de:
http://rhr94.blogspot.com/2012/06/tetraedro-del-fuego.html.
(2011) La agonía del bosque. Recuperado el 12 de setiembre del 2014, de: http://laolladelleprechaun.blogspot.com/2011/07/la-agonia-del-bosque.html.
(2013) ¿Ya te enteraste cómo se contamina el aire. Recuperado el 12 de setiembre del 2014, de:
http://meganotas.com/ya-te-enteraste-como-se-contamina-el-aire-colabora-por-un-mejor-ambiente/.
(2013) Avión F-18 despegando de portaviones. Recuperado el 12 de setiembre del 2014, de: http://fondoescritorio.com.es/aviones/avi%C3%B3n-f18-despegando-de-un-portaviones#.VBW-z_l5Ntx
(2013) Perú requiere 300 mil técnicos al año. Recuperado el 12 de setiembre del 2014, de:
http://laprensa.peru.com/economia/noticia-peru-requiere-300-mil-tecnicos-al-ano-2007
LISTADO DE CONCEPTOS CLAVE
1. Calor de combustión: También llamada entalpía de combustión. Es el calor que se libera cuando reacciona por completo en 1 mol de sustancia en presencia de suficiente oxígeno. Los valores del calor de combustión suelen ser valores negativos, ya que por lo general las combustiones liberan calor hacia el entorno o alrededores.
Ejemplo:
C3H8 (g) + 5O2 (g) 3CO2 (g) + 4H2O (l)
Chong, M. A. (2009). Colaborativo: ayuda de clase. Química 2 (pp. 271). Lima: Pontificia Universidad Católica del Perú.
2. Comburente: Sustancia que capta electrones en una reacción de combustión, tratándose habitualmente del oxígeno atmosférico.
Martínez, A., Villaseñor, J. & Lobato, J. (2003). Termotecnia básica para ingenieros químicos: Bases de Termodinámica Aplicada (pp. 320). España: Universidad de Castilla La Mancha.
3. Combustible: Sustancia que cede electrones en una reacción de combustión, habitualmente compuesta por carbono e hidrógeno en su mayor parte.
Martínez, A., Villaseñor, J. & Lobato, J. (2003). Termotecnia básica para ingenieros químicos: Bases de Termodinámica Aplicada (pp. 320). España: Universidad de Castilla La Mancha.
4. Combustión: Es una reacción química en la que una sustancia reacciona rápidamente con oxígeno liberando luz y calor. Generalmente son reacciones en cadena a través de radicales libres, que se pueden resumir en la oxidación del carbono para formar sus óxidos y la oxidación del hidrogeno dando agua.
Costa, J. M. (2005). Diccionario de química y física (pp. 893). Barcelona, España: Editorial Díaz.
5. Entalpía estándar de formación: Es el cambio de calor relacionado cuando se forma 1 mol de compuesto a partir de sus elementos a una presión de 1 atm.
Chang, R. (2010). Termoquímica. Química (10ª ed., pp. 253). México, D.F.: The McGraw-Hill Companies, Inc. /Interamericana Editores, S.A.
6. Poder calorífico específico: Calor liberado en la combustión completa de un kilogramo de combustible, supuesto que los gases de combustión, combustible y comburente se encuentran a la misma temperatura.
Martínez, A., Villaseñor, J. & Lobato, J. (2003). Termotecnia básica para ingenieros químicos: Bases de Termodinámica Aplicada (pp. 321). España: Universidad de Castilla La Mancha.
APLICACIÓN
1. El calor de combustión, como un valor expresado en KJ/mol, resulta bastante útil para calcular las entalpías de formación de algunas sustancias orgánicas que poseen H, C y O en su estructura; por ejemplo, los hidrocarburos. Esto se debe a que este tipo de compuestos comúnmente participan en las reacciones de combustión para la generación de energía (los hidrocarburos son combustibles y también la principal fuente de energía actualmente. Por ello, el calor de combustión es un concepto muy asociado a esta clase de sustancias; de hecho, es una propiedad característica y bien conocida de los hidrocarburos, por ejemplo.
Conociendo el valor del calor de combustión de una sustancia, es posible determinar su calor de formación, pero se necesita información adicional; por ejemplo, las entalpías de formación de algunas de las sustancias que intervienen en la reacción y de los productos generados. Si el compuesto que analizamos contiene solo H, C y O, los productos generalmente son CO2 (g) y H2O (l) o H2O (g); por ello, se necesita conocer las entalpias de formación del dióxido de carbono gaseoso y el agua líquida (o gaseosa). En algunas ocasiones pueden generarse otros productos adicionales, lo cual dependerá de las sustancias que reaccionan; en ese caso, se deberá conocer también sus entalpías de formación. Ya con esta información es posible calcular el calor de formación del compuesto orgánico mediante el método para calcular calor de reacción usando entalpías de formación. En este caso, nuestro calor de reacción es el calor de combustión y nuestra incógnita es la entalpía de formación del compuesto orgánico. A continuación se muestra un ejemplo:
Referencia 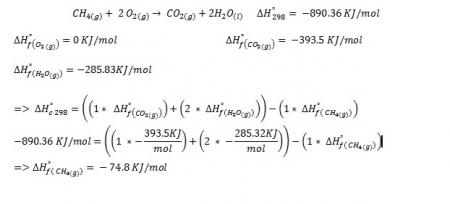
Ragatz, R. A., Hougen, O. A. & Watson, K. M. (1982). Termoquímica. Principios de los procesos químicos (Vol. 1, pp. 301-384). Barcelona, España: Reverté, S.A.
2. Si hablamos del calor de combustión, no como un simple valor, sino como la energía liberada durante un proceso de combustión, entonces las aplicaciones son múltiples:
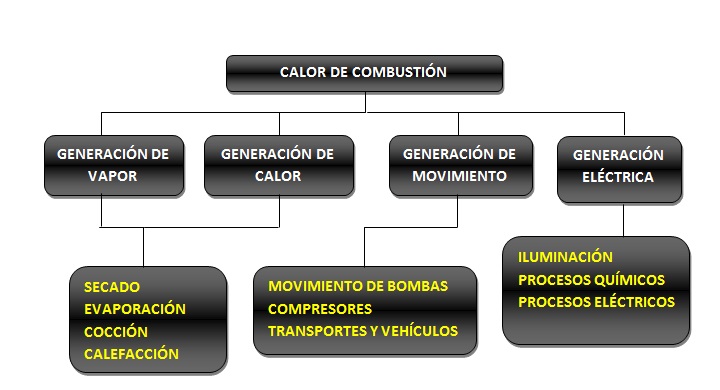
GENERACIÓN DE MOVIMIENTO
Para empezar, este calor es y ha sido, por muchos años, la principal fuente de energía en casi todo el mundo; una aplicación muy común y que todos conocemos de una u otra forma es para el motor de combustión interna.
Un motor de combustión interna es un tipo de máquina que obtiene energía mecánica directamente de la energía química de un combustible que se quema dentro de una cámara de combustión (el cilindro); la combustión se produce dentro de la máquina misma. En el proceso de combustión se aspira una mezcla de aire y combustible hacia el interior del cilindro y se comprime mediante un pistón en movimiento. La mezcla comprimida se enciende para generar la energía (calor de combustión) necesaria para el movimiento del vehículo. Cuando ocurre la combustión, los gases de la mezcla de aire y el combustible que se quema se expanden dentro del cilindro a una presión muy alta; esta presión empuja el pistón hacia abajo en el cilindro. El pistón está conectado a una biela y otras partes (el cigüeñal) que se encargan de convertir el movimiento hacia arriba y hacia abajo del pistón en movimiento rotatorio, el cual se transfiere a las ruedas del vehículo para permitir su movimiento. Casi todos los motores modernos son motores con ciclo de cuatro tiempos, lo cual significa que el pistón se mueve a lo largo de la longitud del cilindro cuatro veces para completar un ciclo de combustión.
Este es el funcionamiento básico de todo motor de combustión interna; desde luego, existen pequeñas diferencias de acuerdo al tipo de motor, por ejemplo, el motor de encendido por chispa y el motor de encendido por compresión. La diferencia primordial entre estos es que en el de compresión el combustible es rociado directa y completamente dentro del cilindro; mientras que en el encendido por chispa, el combustible se bombea primero en un sistema de ingesta donde se mezcla con aire antes de entrar al cilindro y encenderse. Esta diferencia acarrea otras en cuanto a la eficiencia, la potencia, la relación aire-combustible, el proceso de encendido, etc.
Esto es todo lo que hay saber sobre los motores por ahora, porque lo realmente concerniente es la combustión y el calor que genera y hace posible el funcionamiento del motor. Es evidente la utilidad del calor de combustión en los motores, pues está energía incrementa la temperatura y la presión en el interior del cilindro, provocando que los gases se expandan y empujen el pistón, cuyo movimiento se transforma en movimiento rotatorio mediante un sistema de biela. En este caso, el calor de combustión (energía) se ha transformado en trabajo que hace posible el movimiento de un vehículo. Su importancia salta a la vista, ya que casi todos los vehículos en el mundo emplean el calor generado por la combustión como fuente de energía; gracias a ello, podemos movilizarnos diariamente, la vida sería muy complicada sin los autos o buses que empleamos para desplazarnos.
Referencia
Fygueroa, Simón J. & Araque, Jesús O. (2005). Combustión en MCIA. El proceso de combustión en motores de combustión interna (1ra ed., pp. 1-24). Mérida, Venezuela: Editorial Venezolana.