CONCEPTOS
2.1. Primera ley de
Cualquier energía perdida por el sistema debe ser ganada por su entorno, a esta conservación de energía se le conoce como
Energía interna (ΔE): Suma de todas las energías cinéticas y potenciales del sistema.
ΔE = q + w
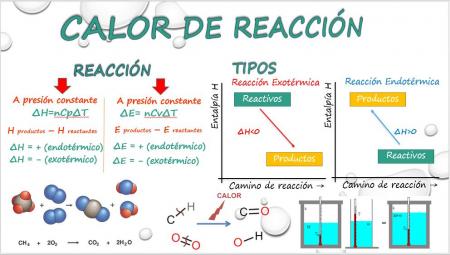
Cuando el sistema absorbe calor se le denomina proceso endotérmico y cuando la pierde, exotérmico.
| + | – | |
|
q w ΔE |
Gana calor Trabajo sobre el sistema Ganancia neta de energía |
Pierde calor Trabajo del sistema Perdida neta de energía |
.
Función estado: El valor de una función estado no depende de cómo se llevo a cabo el cambio de estado del sistema, solo el estado inicial y el final. ΔE es una función estado.
H. Eugene LeMay,JR., Theodore L. Brown, Catherine J. Murphy, Bruce E. Bursten y Patrick M. Woodward. (2014). Química: La ciencia central (pp.164-168). Cámara Nacional de
2.2. Entalpía(H)
La entalpía es una función que se debe a la relación de tres funciones de estado: E, P y V.
H= E + PV
El trabajo en un proceso donde la presión es constante se halla de la siguiente forma:
w= -P ΔV
Cuando ocurre un cambio a presión constante lo que sucede es lo siguiente:
ΔH= ΔE + PΔV=(q + w) – w = q perdido
La entalpía de reacción o calor reacción es la que acompaña a una reacción química.
H. Eugene LeMay,JR., Theodore L. Brown, Catherine J. Murphy, Bruce E. Bursten y Patrick M. Woodward. (2014). Química: La ciencia central (pp.169- 171). Cámara Nacional de
2.2. Entalpías de formación (ΔHF0)
Un proceso empleado para tabular los datos termoquímicos es la formación de un compuesto a partir de sus elementos constitutivos. El cambio de entalpía asociado con este proceso se conoce como entalpía de formación (ΔHF).
El cambio de entalpía estándar (ΔH0) de una reacción se define como el cambio de entalpía cuando los reactivos y los productos se encuentran en su estado estándar.
Estos dos conceptos (ΔHF y ΔH0) nos sirven para poder entender la entalpía de formación estándar (ΔHF0), que es el cambio de entalpía de un mol de compuesto a partir de sus elementos constitutivos en un estado estándar, y la que se usa para poder hallar el calor reacción de las reacciones químicas.
ΔH0 = (Sumatoria de ΔHF0 de los productos) – (Sumatoria de ΔHF0 de los reactantes)
Ejemplo:
2 NH3(g) → N2H4(l) + H2(g) ΔH0298 = ?
ΔH0298 = [ΔHF0 (N2H4(l)) + ΔHF0 (H2(g))] – 2 ( ΔHF0 (NH3(g)))
ΔHF0= [50,63 kJ/mol + 0 kJ/mol] – 2 (- 46,3 kJ/mol)
ΔH0298 = 143,23 kJ
H. Eugene LeMay,JR., Theodore L. Brown, Catherine J. Murphy, Bruce E. Bursten y Patrick M. Woodward. (2014). Química: La ciencia central (pp.183-185). Cámara Nacional de
2.3. Energias de enlace
Las entalpías de enlace promedio sirven para estimar el calor reacción de las reacciones en las que se rompen enlaces y se forman nuevos. Se considera que cuando ser rompen enlaces se gana energía (endotérmico) y cuando se crean se pierde energía (exotérmica).
Imagine una reacción química y analice dos etapas:
- Para poder romper los enlaces de los reactantes se necesita proporcionar energía, por lo tanto la entalpía del sistema aumentara por las entalpías de enlaces rotos.
- Para poder generar enlaces en los productos se libera energía, por lo tanto la entalpía del sistema disminuirá.
ΔH= (Sumatoria de entalpías de enlaces rotos) – (Sumatoria de entalpías de nuevos enlaces)
Ejemplo:
H H
I I
H-C-C- H (g) + 7 O2 (g) à 4 O=C=O + 6 H-O-H
I I
H H
ΔH= [12(C-H) + 2(C-C) + 7(O2)] – [8(C=O)+ 12(O-H)]
ΔH=[12(413 KJ) + 2(348 KJ) + 7(495 KJ)] – [8( 799 KJ) + 12(463 KJ)]
ΔH= -2831 KJ
H. Eugene LeMay,JR., Theodore L. Brown, Catherine J. Murphy, Bruce E. Bursten y Patrick M. Woodward. (2014). Química: La ciencia central (pp.316). Cámara Nacional de
2.5. Ley de Hess
La ley de Hess establece que si una reacción se produce en etapas, la ΔH de la reacción será igual a la suma de las entalpías de las etapas individuales. Como la entalpía es una función estado, es decir que no depende de su trayectoria, la ley de Hess se puede aplicar siempre y cuando se conozco la trayectoria de la ΔH de cada proceso. Esto permite calcular un gran número de reacciones mediante un grupo de reacciones pequeñas.
Es muy útil debido a que te ayuda a encontrar la ΔH de reacciones difíciles de medir directamente. Ejemplo:
CH4 (g) + 202(g) à CO2 (g) +2H2 (l) ΔH= -802 KJ
(sumar) 2H2O (g) à 2H2O (l) ΔH= -88 KJ
————————————————————————
CH4 (g) + 2O2 ( g)+ 2H2O (g) à CO2 (g) + 2H2O (l) + 2H2O (g) ΔH=-890 KJ
Ecuación neta: CH4 (g) + 2O2 (g) à CO2 (g) + 2H2O (l)
H. Eugene LeMay,JR., Theodore L. Brown, Catherine J. Murphy, Bruce E. Bursten y Patrick M. Woodward. (2014). Química: La ciencia central (pp.181-182). Cámara Nacional de
2.6. Calorimetria
Hay una forma experimental de poder hallar la ΔH midiendo flujo de calor que acompaña a una reacción a presión constante. Esta medición de flujo de calor se conoce como calorimetría debido a que en esta se usa el calorímetro.
Capacidad calorífica(C).- Es la cantidad de calor requerido para elevar su temperatura 1K.
Calor específico(c).- Que es la capacidad calorífica de un gramo de sustancia. Y se determina de la siguiente forma:
Calor especifico= (cantidad de calor transferido)/ (gramos de sustancia) X (cambio de temperatura)
Calorimetría a presión constante: Calor de absorbido o liberado = q disoln
q disoln = (calor especifico de la disolución) X (gramos de disolución) X ΔT = -q rxn
| Exotérmico | Endotérmico |
|
q lib= q reacción q ab = q calrim + q solución q calrim = C ΔT q solución= m c ΔT q lib + q ab=0 |
q ab= q reacción q lib = q calrim + q solución q calrim = C ΔT q solución = m c ΔT q lib + q ab = 0 |
Calorimetría a volumen constante (bomba calorimétrica):
q rxn = -Ccalorim x ΔT
q lib= q rxn q lib + q ab = 0
q ab= q H2O +q bomba
q H2O= m c ΔT
q bomba= C ΔT
ΔH= E + RTΔn
H. Eugene LeMay,JR., Theodore L. Brown, Catherine J. Murphy, Bruce E. Bursten y Patrick M. Woodward. (2014). Química: La ciencia central (pp.175-178). Cámara Nacional de
Aplicación
El estudio sobre el calor específico nos ha traído muchos beneficios de diversos tipos, como la implementación en las nuevas construcciones y por otro lado, un mayor control sobre lo que consumimos.
Una de las aplicaciones del calor de reacción es el implemento de aparatos que soporten temperaturas muy altas sin que puedan ser alteradas, ya que conociendo el calor específico se puede tener la seguridad de poder usar ciertos materiales al momento de hacer experimentos o fabricaciones a temperaturas altas. De igual forma, se pueden emplear materiales, con calor específico alto, en las nuevas construcciones diseñadas contra los incendios.
Otra de las aplicaciones de estas leyes, es el uso de los automóviles y medios de transporte a vapor, ya que usan la combustión de cierta materia en una determinada temperatura y la presión para hacer trabajar un pistón y así, poder hacer girar las ruedas necesarias.
El calor de reacción también se usa en la alimentación, ya que sabiendo el calor específico de cada alimento, se podrá saber las calorías que aportará al cuerpo humano. Teniendo un mayor control de las calorías consumidas y calorías quemadas se logrará un mayor balance y así, una mejor salud.
