CONCEPTOS CLAVE:
Energía libre de Gibbs: Es una cantidad termodinámica notable que nos ayuda a saber mediante la utilización de S y H de una reacción dada a presión y temperatura constante si esta es o no espontánea. Es una función de estado. Su ecuación es: G = H – TS
BROWN,T(2009) Química: la ciencia central. Rubén Fuerte Rivera. Décimo primera ed. México: Pearson Educación de México,S.A.
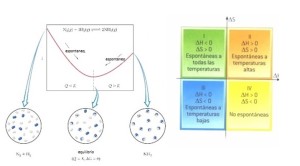
∆G: Debido a que muchas reacciones se llevan a cabo bajo condiciones de presión y temperatura casi constantes, los químicos, bioquímicos e ingenieros utilizan este signo y su magnitud para diseñar y modificar las diversas reacciones químicas y bioquímicas. Su valor nos da el límite teórico de cuánto trabajo puede realizar un proceso.Esta relación explica por qué ∆G se conoce como energía libre. Es la parte del cambio de energía de una reacción espontánea que es libre de realizar trabajo útil. La energía restante entra al ambiente como calor. Su ecuación es: ∆G = ∆H – T∆S
BROWN,T(2009) Química: la ciencia central. Rubén Fuerte Rivera. Décimo primera ed. México: Pearson Educación de México,S.A.
Entalpía (H) : El calor de un sistema a presión constante. Es una propiedad extensiva y una función de estado. Se expresa como: ΔE = ΔH – PΔV
BROWN,T(2009) Química: la ciencia central. Rubén Fuerte Rivera. Décimo primera ed. México: Pearson Educación de México,S.A.
Energía libre estándar de formación: Es una función de estado como la entalpía, la cual implica un conjunto de estados estándar dependiendo del estado de la materia :sólido (sólido puro),líquido ( líquido puro), gas (1 atm), disolución (1M), las energías libres de los elementos en sus estados estándares fijan en cero, además son útiles para calcular el cambio de energía libre estándar de los procesos químicos.
BROWN,T(2009) Química: la ciencia central. Rubén Fuerte Rivera. Décimo primera ed. México: Pearson Educación de México,S.A.
Estado de equilibrio: se utiliza la ecuación ΔG=ΔG°RT para deducir la relación entre ΔG° y la constante de equilibrio, K.En el equilibrio, ΔG=0. Además, recuerde que el cociente de reacción, Q, es igual a la constante de equilibrio,K , cuando el sistema está en equilibrio.Por lo tanto, en el equilibrio la ecuación se transforma de la siguiente forma: ΔG=ΔG°+RT en 0=ΔG°+RTlnK siendo ΔG°=-RTlnK
BROWN,T(2009) Química: la ciencia central. Rubén Fuerte Rivera. Décimo primera ed. México: Pearson Educación de México,S.A.
Proceso espontáneo: Proceso que puede proceder en una sola dirección dada, como se escribe o describe, sin la necesidad de ser impulsado por una fuente de energía externa. Ejemplo: Consideremos la fusión del hielo. Cuando la temperatura del ambiente sea mayor a 0°C a presión atmosférica, el hielo se fundirá espontáneamente.
BROWN,T(2014) Química: la ciencia central. Rubén Fuerte Rivera. Décima segunda ed. México: Pearson Educación de México,S.A.
Entropía: Está asociada con el grado de desorden del sistema o el grado de distribución o dispersión de la energía del sistema, ocasionado por los diversos movimientos de las moléculas. Se puede relacionar los cambios de entropía con los de calor y temperatura. Es una función de estado. En un proceso isotérmico se puede obtener la relación: ΔS = qrev/ T
BROWN,T(2014) Química: la ciencia central. Rubén Fuerte Rivera. Décima segunda ed. México: Pearson Educación de México,S.A.
APLICACIONES DE ESPONTANEIDAD
Lo que necesitamos aquí es hallar la espontaneidad del metano:
Lo primero que debemos tener es una ecuación que se encuentre balanceada y tener las entropías de las sustancias que conforman la ecuación.
- CH4 (S) + 2O2 (g) ——> CO2 (g) + 2H2O(l)
– ΔH°C = -890.3 KJ/mol
– ∆Ssist = {[(213.4) + 2(188.7)] – [186.3 + 2(204.8)]} J/mol.K = -5.1 J/mol.K
– ∆Sent = (890.3 KJ/mol) / 298K = 2.988 J/mol.K
∆Suni = (-5.1+2.988)J/mol.k = -2.112 J/mol.K
- KClO3(s) —> KCl(s) + 3/2 O2 (g)
- ΔH°C = -44.7 KJ/mol
- ΔSsist = {[(82.7) + 3/2(204.8)] – [143]} J/mol.K = 246.9 J/mol.K
- ΔSent = (-44.7KJ/mol)/298K =-0.15 J/mol.K
ΔSuni= (246.9-0.15)J/mol.K = 246.75 J/mol.K
IES Victoria Kent. TERMOQUÍMICA II. Recuperado el 18 de abril del 2015, de:
APLICACIONES DE ENERGIA LIBRE
ΔGº = ΔHº – ΔTSº
ΔGº = -114*103 J/mol – 298K*11,1 J/molK
ΔGº = -1.17*105 J/molK
Energia libre de gibbs y espotaneidad. Recupeado el 18 de abril del 2015, de:
http://ejercicios-fyq.com/?Energia-libre-de-Gibbs-y