Trabajo realizado por el Equipo 4: Reacción 0, H2O2 y Quimitube.
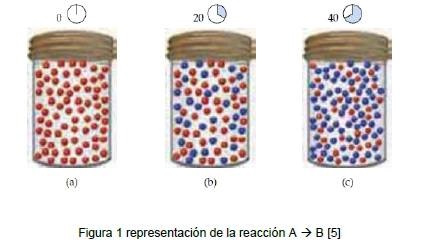
Imagen tomada de:
1.- VELOCIDAD DE REACCIÓN
La velocidad de reacción es el cambio en la concentración de los reactivos o productos por unidad de tiempo. De este modo las unidades de la velocidad de reacción mayormente son la molaridad por segundo (mol/s), es decir, el cambio de concentración sobre el intervalo de tiempo.
Factores influyentes
Debido a que las reacciones comprenden la ruptura y formación de enlaces, las velocidades de reacciones dependen de la naturaleza de los reactivos mismos. Los siguientes factores nos permiten modificar las velocidades en las que ocurren reacciones específicas:
- El estado físico de los reactivos los reactivos deben colisionar entre si para reaccionar. Entre más colisiones, mas reaccionan.
- Las concentraciones de los reactivos mientras mayor sea la concentración, mayor será la frecuencia de colisiones de moléculas, lo que conlleva un aumento de velocidad.
- La temperatura a la que ocurre la reacción a mayor temperatura, mayor velocidad de reacción aumenta.
- La presencia de un catalizador los catalizadores son sustancias q aceleran las velocidades de reacción sin consumirse.
Bibliografía:
Brown, Theodore L..,cols. (2009) Química La Ciencia Central decimo primera edición (pp574) PEARSON EDUCACION, México.
2.- LEY DE VELOCIDAD
Una de la formas de conocer el efecto de la concentración sobre la velocidad de reacción es determinar la forma en que la velocidad inicial de una reacción depende de las concentraciones iniciales, a la ecuación que muestra esta relación se le conoce como ley de velocidad. Para una reacción general
aA + bB → cC + dD
La ley de velocidad generalmente tiene la forma
Velocidad = k [A]^m[B]^n
A la constante k se le conoce como constante de velocidad.
A los exponentes m y n se le conoce como ordenes de reacción, por lo general son números enteros pequeños, usualmente 0,1 o 2.
Bibliografía:
Brown, Theodore L..,cols. (2009) Química La Ciencia Central decimo primera edición (pp580) PEARSON EDUCACION, México.
3.- CONSTANTE DE VELOCIDAD
La constante k vista en la ecuación de la ley de velocidad es conocida como constante de velocidad. La magnitud de k varía según la temperatura y por lo tanto determina como afecta la temperatura a la velocidad.
Si conocemos la ley de velocidad para una reacción y su velocidad para un conjunto de concentraciones de reactivos, podemos calcular el valor de la contante k. Por ejemplo la reacción de NH2+ con NO2-:
Velocidad inicial observada (M/s): 5.4x 10^(-7)
Concentración inicial de NH2+ (M): 0.0100
Concentración inicial de NO2- (M): 0.200
5.4 x 10^(-7) M/s = k(0.0100 M)(0.200 M)
K= 2.7 x 10^(-4) M^(-1) s^(-1)
Bibliografía:
Brown, Theodore L..,cols. (2009) Química La Ciencia Central decimo primera edición (pp581) PEARSON EDUCACION, México.
4.- VIDA MEDIA DE UNA REACCIÓN.-
A medida que procede una reacción, la concentración del reactivo o los reactivos disminuye. Otra medición de la rapidez de una reacción, que se relaciona con la concentración y el tiempo, es la vida media, t1/2, que es el tiempo requerido para que la concentración de un reactivo disminuya a la mitad de su valor inicial.
Bibliografía:
Chang, Raymond (2007) Química / Raymond Chang 10 edición. México, D.F.: McGraw-Hill Interamericana (pp.582)
5.- EL ORDEN DE UNA REACCIÓN.-
Las expresiones de las leyes de rapidez de una reacción a partir de la constante de rapidez y de la concentración de los reactivos. Las leyes de la rapidez, también se utilizan para determinar las concentraciones de los reactivos en cualquier momento durante el curso de una reacción.
Reacciones de primer orden: Es una reacción cuya rapidez depende de la concentración de un reactivo elevada a la primera potencia.
Reacciones de segundo orden: Es una reacción cuya rapidez depende de la concentración de uno de los reactivos elevada a la segunda potencia o de la concentración de dos reactivos diferentes, cada uno elevado a la primera potencia.
Reacciones de orden cero: Las reacciones de primer y segundo orden son los tipos de reacciones más conocidas. Las reacciones de orden cero son poco comunes. Por tanto, la rapidez de una reacción cero es una constante, independiente de la reacción de los reactivos.
Bibliografía:
Chang, Raymond (2007) Química / Raymond Chang 10 edición. México, D.F.: McGraw-Hill Interamericana (pp.577-587)
6.- MECANISMOS DE REACCIÓN.-
El mecanismo de reacción es una descripción detallada, paso a paso, de la forma en la que los reactivos se transforman en los productos. La descripción debe incluir:
- El movimiento de los electrones que producen la ruptura y formación de enlaces.
- Las relaciones espaciales de los átomos durante dichas transformaciones.
En el caso ideal, un mecanismo debería responder a los cambios estructurales y a los energéticos que ocurren en cada paso de la reacción. Nunca hay que esperar que un mecanismo quede completamente demostrado, pues es muchas reacciones no es posible conseguir datos experimentales para cada detalle del proceso. A menudo es posible que haya más de un camino distinto para una reacción.
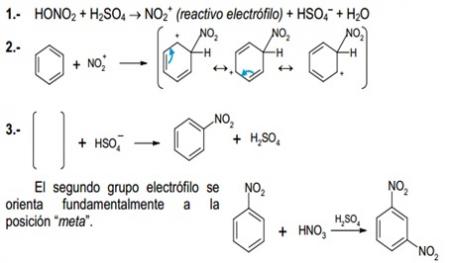
6.2.2.1 Nitración (efecto “–M”).
MECANISMO: La reacción tiene lugar en tres etapas.
Bibliografía:
ü Documento extraído de Internet:
Mónica, G. (2010, 26 de mayo). Teoría de las colisiones. Recuperado el sábado 19 de abril de 2014, de:
http://quimica.laguia2000.com/reacciones-quimicas/teoria-de-las-colisiones
7.- TEORÍA DE LAS COLISIONES.-
Esta teoría está basada en la idea de que partículas reactivas deben colisionar para que una reacción ocurra, pero solamente una cierta fracción del total de colisiones tiene la energía para conectarse efectivamente y causar transformaciones de los reactivos en productos. Esto es porque solamente una porción de las moléculas tiene energía suficiente y la orientación adecuada (o ángulo) en el momento del impacto para romper cualquier enlace existente y formar nuevas.
La cantidad mínima de energía necesaria para que esto suceda es conocida como energía de activación.
Con la temperatura aumentando, la energía cinética media y velocidad de las moléculas aumenta, pero esto es poco significativo en el aumento en el número de colisiones.
La tasa de reacción aumenta con la disminución de la temperatura porque una mayor fracción de las colisiones sobrepasa la energía de activación.
Los átomos de las moléculas de los reactivos están siempre en movimiento, generando muchas colisiones (choques). Parte de estas colisiones aumentan la velocidad de reacción química. Cuantos más choques con energía y geometría adecuada exista, mayor la velocidad de la reacción.
Hay dos tipos de colisiones:
- Horizontal – Colisión más lenta
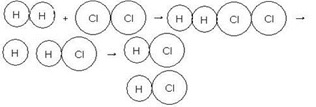
Imagen .Colisión horizontal
Fuente: http://quimica.laguia2000.com/reacciones-quimicas/teoria-de-las-colisiones
- Vertical – Colisión más rápida, colisión efectiva
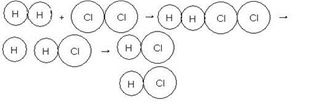
Imagen .Colisión horizontal
Fuente: http://quimica.laguia2000.com/reacciones-quimicas/teoria-de-las-colisiones
Bibliografía:
ü Documento extraído de Internet:
Politécnico de Cartagena (2012, 01 de noviembre). Cinética química. Recuperado el sábado 19 de abril de 2014, de:
http://www.politecnicocartagena.com/wp-content/uploads/2012/11/cinetica_quimica.pdf
8.- ENERGIA DE ACTIVACIÓN
Es la energía mínima que se necesita para iniciar una reacción química.
Bibliografía:
Brown T., LeMay H. y Bursten B. (1998). Química la ciencia central 9ª edición. México: Prentice Hall Hispanoamericana S.A. (pp. 544)
9.- CATALIZADOR.- Es una sustancia que aumenta la rapidez de una reacción mediante la disminución de la energía de activación. Lo hace mediante la trayectoria alternativa de la reacción. El catalizador puede reaccionar para formar un intermediario con el reactivo, pero se regenera en alguna de las etapas subsiguientes, por lo que no se consume en la reacción.
Existen 3 tipos de catálisis
- Catálisis heterogénea.- Es donde los reactivos y el catalizador se encuentran en fases distintas. Por lo general, el catalizador es un sólido y los reactivos son gases o líquidos.
- Catálisis homogénea.- Es donde los reactivos y el catalizador están dispersos en una sola fase generalmente liquida. La catálisis acida y la básica constituyen los tipos más importantes de catálisis homogénea en disolución liquida.
- Catálisis enzimática.- Son catalizadores biológicos.
Bibliografía:
Chang, Raymond (2007) Química / Raymond Chang 10 edición. México, D.F.: McGraw-Hill Interamericana (pp. 594 – 600)
C) APLICACIONES DE LA LEY DE VELOCIDAD
En el uso de catalizadores se puede acelerar o disminuir su velocidad de reacción. Esto es de gran utilidad dependiendo del proceso y objetivo a lograr. Por ejemplo en el caso de los antioxidantes: la función del catalizador es disminuir la velocidad de oxidación drásticamente. Esta aplicación es muy importante y de uso común en las etapas finales del mantenimiento y fabricación de los artefactos metálicos pues prolongan la vida útil del artefacto.
-Un caso opuesto al anterior sería el de aumentar la velocidad de reacción. Por ejemplo en el caso de las barras luminosas “Cyalume”1 cuando se aumenta la temperatura de ésta, la reacción (que ocurre dentro de la barrita) es mucho más rápida e ilumina más. Aproximadamente, el 90% de los productos químicos manufacturados han sido fabricados en procesos que por lo menos una etapa en la que se emplea un catalizador2. El uso general de los catalizadores en los procesos industriales es fundamental para aumentar la producción de manera rápida y eficazmente.
-Las velocidades de reacción no solo son útiles para extender o acortar el tiempo de reacción, sino que, debido a que la mayoría de estas están relacionadas con la temperatura del proceso se puede calcular el tiempo aproximado en el que se dará la reacción. Esto es un factor muy importante, por ejemplo, en las industrias de alimentos se debe tener en cuenta la caducidad de sus productos y dependiendo de este adicionarle el factor de seguridad dependiendo de las condiciones en las que se encontrará (una vez adquirido por los usuarios).
Referencias
1 Brown T., LeMay H. y Bursten B. (2004).Química la ciencia central 9ª edición. Pg.543
México: Pearson Educación México S.A.
2 Fundamentos y Aplicaciones de la Catálisis Homogénea, L.A. Oro y E. Sola, Eds., P.U. Zaragoza (2000).
Organotransition Metal Chemistry and Catalysis, Education in Advanced Chemistry, B. Marciniec, Ed., Poznan, (2003).
Hydrogenation by homogeneous catalysts. Encyclopedia of Catalysis, I.V. Horváth, E. Iglesia, M.T. Klein, J.A. Lercher. A.J. Rusell and E.I. Stiefel, Eds, John Wiley & Sons, (2003).