Drenaje ácido de mina (DAM): problemática en los cuerpos de agua y en la biósfera
Autores: David Garagorri Linares y Felipe Santiago Vela Pajares
Es de conocimiento general que la industria minera representa gran parte de la historia y economía peruana. El Perú es uno de los países mineros más importantes en explotación y exploración tanto a nivel regional como internacional (Dammert y Molinelli, 2007). Además, el país es reconocido entre los mayores productores de metales básicos (i.e. cobre, plomo y zinc) y preciosos (i.e. oro y plata) actualmente.
Lamentablemente, la minería genera grandes pasivos ambientales sobre los recursos hídricos. Como resultado del reciente enfoque ambientalista de la industria, se han venido desarrollando varios trabajos de investigación acerca de las aguas ácidas producto de la actividad extractiva. De hecho, su origen es entendido como la oxidación de grandes cuerpos piríticos que entran en contacto con el ambiente. En este sentido, el DAM tiene efectos secundarios tanto en la hidrósfera como en la biósfera. Por consiguiente, el presente artículo explorará dichos efectos, con una primera sección vinculada a la química y origen del drenaje ácido de mina; una segunda sección con el desarrollo de sus efectos en los principales ámbitos de impacto tales como la fauna marina, plantas y suelos, y los seres humanos; y, por último, se presentarán unas conclusiones generales.
- Química y origen del DAM
Las menas metálicas, minerales de los cuales se extraen metales, pertenecen a la clase de los sulfuros; algunas menas son: la calcopirita (CuFeS2), la galena (PbS) y la esfalerita (ZnS). La pirita (FeS2) es considerada el sulfuro más ubicuo entre sus pares compartiendo algunas semejanzas con otras especies minerales como su dimorfo marcasita (FeS2-ortorr.) y la pirrotita (Fex-1Sx). La oxidación del sulfuro de hierro produce ácido sulfúrico, el cual libera cationes hidrógeno al ser disuelto (Rivera Uria, M.Y. et. al. 2020).
Reacción 1. Oxidación de la pirita en medio acuoso y con presencia de oxígeno gaseoso.

Como se muestra líneas arriba, otro reactivo es el agua. Algunas fuentes de agua son las lluvias percolantes en el macizo rocoso y acuíferos subterráneos expuestos por el laboreo minero. En general, las zonas mineras no escasean en contenido hídrico.
Un estudio en cooperación entre universidades sudafricanas propone que las aguas al tornarse muy ácidas tendrán mayor capacidad de adsorción de metales pesados. De aquí que estos se encuentren en suelos y en la cuenca hidrográfica (Shabalala & Ekolu, 2019).
Figura 1. DAM del “Río Tintillo” de la minera andaluza de Rio Tinto, Huelva.


El tono rojizo característico de este fenómeno (ver figura 1) se debe a la oxidación posterior del catión ferroso, ion lixiviado directamente de la pirita, resultando en un catión férrico (Sánchez España et. al., 2005). Mientras se mantenga el carácter oxidante, dada la presencia de oxígeno atmosférico gaseoso, la excitación de Fe(II) a Fe(III) se dará espontáneamente (Bejan & Bunce, 2015). El Fe(III) se considera un ion “cromóforo” porque provee tonos distinguibles al encontrarse en bajas concentraciones.
Reacción 2. Reacciones parciales de la oxidación del catión ferroso (ánodo) y la reducción del catión hidrógeno (cátodo), lo que es equivalente al traspaso de un electrón entre ambos cationes.
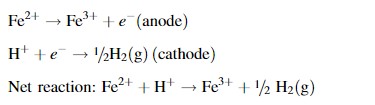
En resumen, la acidez y coloración en el DAM es comprendido como una serie de reacciones químicas que producen cationes hidrógeno y férrico, respectivamente. Los factores más importantes son la disponibilidad de moléculas de agua y oxígeno atmosférico.
Figura 2. Modelo completo de oxidación de la pirita.
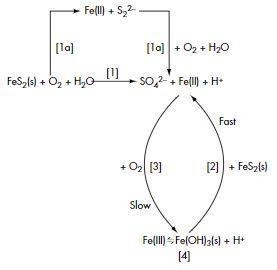
Notar que este fenómeno se origina en varias de las etapas mineras, desde la operación in situ hasta la lixiviación de stockpiles y en derrames de relaves mineros. Por otro lado, en la normativa vigente nacional se especifican tres indicadores, siendo los dos primeros consecuencia de la disolución de H2SO4: 1) Potencial hidrógeno (pH) muy bajo, 2) Aniones sulfato, y 3) Metales pesados disueltos y precipitados (MINEM, s/f).
En la tabla 1 se comparan dos cuerpos de agua de locaciones cercanas: una con impacto ácido y otra sin este. La primera es producto de una mina que operó hace décadas en la zona.
Tabla 1: Comparación de las concentraciones entre un cuerpo hídrico con DAM y un cuerpo hídrico no impactado.

- Efectos negativos del DAM en la biosfera (debe ir 2)
Las consecuencias de tener un pH ácido o bajo, y de que el cuerpo de agua contenga metales en altas concentraciones, repercute en distintos ámbitos tanto naturales como sociales. En este caso, se desarrollarán los siguientes impactos, ya que son los que afectan de manera más directa a la biósfera y la hidrósfera.
2.1. Fauna marina
La asimilación de metales en un cuerpo de agua y de bajo pH en los peces que lo habitan se da de manera directa e indirecta. La fauna acuática puede obtener estos metales mediante el consumo de plantas (de manera indirecta) o acumulando los contaminantes en tejido producto del contacto con el agua contaminada (de manera directa) (Khayatzadeh J & Abbasi E, 2010)
La ingesta o acumulación de metales por parte de la fauna acuática tiene numerosos efectos, los cuales serán mencionados a continuación. En primer lugar, el crecimiento de los peces se ve afectado, sobre todo el de las larvas o de peces pequeños, comprometiendo futuras generaciones. Esto puede no llegar a matarlos, pero sí consigue que, al tener un menor tamaño, no estén aptos para competir por la comida, o no poder mantener los hábitats de su especie, terminando en una posible extinción. (Khayatzadeh J & Abbasi E, 2010)
También, al tener metales en órganos vitales y en la sangre, la tasa de mortalidad se incrementa por mal funcionamiento de los mismos y por falta de oxigenación. (Khayatzadeh J & Abbasi E, 2010)
Por otro lado, bajos niveles de pH pueden hacer un ambiente acuático inhóspito para peces. Se ha observado esto en distintos países con presencia de aguas ácidas (Países Escandinavos y US). Estos estudios muestran una fuerte correlación entre el valor del pH y la presencia de peces en cuerpos de agua.
En los siguientes gráficos se puede comparar los distintos valores de pH para un número considerable de lagos de diferentes partes del mundo. Un comportamiento claro es que a menor pH, el número de lagos sin peces aumenta considerablemente. De la misma forma, se puede visualizar que conforme pasa el tiempo, entre 1930 y 1975, la cantidad de lagos con un pH ácido sin peces se incrementa de forma considerable. (Schofield, 1976).
Figuras 3 y 4. Distribución de frecuencias del pH y de población de peces en lagos cercanos a Adirondack Mountains, EE.UU.


El resultado de bajo pH o de aguas ácidas en los peces son los siguientes. Primero, se observa menor densidad poblacional como ya se explicó. Segundo, y esta consecuencia está relacionada a la primera, hay una reducción en el tamaño de los peces conforme pasan las generaciones. Tercero, la esperanza de vida baja en toda la fauna afectada debido a problemas en los órganos y mal funcionamiento de los mismos.
2.2. Plantas y suelos
Se pueden contaminar las plantas que están presentes en el cuerpo de agua debido a su capacidad de absorción. También se pueden contaminar plantas que han sido irrigadas por agua que contiene metales o la flora puede absorber metales de los suelos en los que está presente, por lo que la flora es afectada de manera directa e indirecta. (Kamran et al., 2013)
En cuanto a los suelos, sucede lo mismo. Al estar en contacto con aguas ácidas. Ya sea por flujo subterráneo o irrigación, los metales se ven depositados en los estratos cuando pierden solubilidad, por ejemplo, en los fondos de cuerpos de agua. Esto se da, puesto que puede haber fluctuaciones de condiciones termodinámicas o de disponibilidad de radicales libres que reducen la solubilidad de los metales, generando la sedimentación de los mismos.
Los suelos con presencia de sulfatos, pueden dañar distintas estructuras construidas, ya que deteriora la resistencia del concreto con el tiempo. Esto se puede dar tanto con suelos o con agua que presente sulfatos y que esté en contacto directo con concreto o acero estructural.
Las consecuencias en la flora de esta contaminación son tres. Afecta negativamente el crecimiento, daña las raíces de las mismas y minimiza la toma de nutrientes esperada, tanto del agua como del suelo.
2.3. Seres humanos
DAM es una seria amenaza a la salud de los seres humanos debido a su alto contenido de metales en un ecosistema (Sangita & Prasad, 2010). Los metales, al no ser biodegradables tienden a acumularse cuando reducen su solubilidad o cambian las condiciones en las que se encuentran.
Las formas en la cual un ser humano puede tener contacto con altas concentraciones de metales son las siguientes.1) Presencia en cuerpos de agua que se utilicen para el consumo humano, 2) Presencia de metales en peces que habitan en un cuerpo de agua con DAM, 3) Presencia de metales en plantas que se encuentra en un cuerpo de agua con DAM o cerca a uno.
Por lo tanto, la contaminación en seres humanos es de manera indirecta en su mayoría. Esto se da también a que se encuentra al final de la cadena alimenticia.
Las consecuencias de la ingesta de metales pesados son variadas. Por un lado, se presentan efectos que tienen los metales pesados en todo ser vivo, que es comprometer el crecimiento y la absorción de nutrientes, afectando el sistema inmunológico. Por otro lado, se demostró que la presencia de metales en órganos de seres vivos por consumo de alimentos es cancerígena. (More et al. 2003).
En cuanto al consumo de agua con pH ácido la OMS dice que esto causa irritación en la piel y ojos que puede ser hasta irreversible dependiendo del grado de acidez del agua consumida (WHO, 2003).
- Conclusiones
Los DAM son recurrentes en cualquier zona minera dada la frecuencia de ocurrencia de metales. La acidificación de cuerpos de agua y disolución de metales pesados tiene consecuencias directas en la biósfera, impactando desde la diversidad genética y funcional de las plantas y la calidad de los suelos, hasta la vida y normal desarrollo de especies acuáticas y seres humanos.
La extensión de las consecuencias del DAM es espontáneamente irreversible, ya que contribuye a la rápida degradación del medio ambiente, comprometiendo el desarrollo sostenible de diferentes actividades antropogénicas que conviven con la actividad minera.
REFERENCIAS
Bejan & Bunce (2015). Department of Chemistry, Electrochemical Technology Centre, University of Guelph, Canada. Acid mine drainage: electrochemical approaches to prevention and remediation of acidity and toxic metals. http://dx.doi.org/10.1007/s10800-015-0884-2
Dirección General de Asuntos Ambientales Mineros. Ministerio de Energìa y Minas. Guía Ambiental para el Manejo de Drenaje Ácido de Mina. S/f.
Kamran, S., Shafaqat, A., Samra, H., Sana, A., Samar, F., Muhammad, B. S., Saima, A. B., & Hafiz, M. T. (2013). Heavy Metals Contamination and what are the Impacts on Living Organisms. Greener Journal of Environmental Management and Public Safety, 2(4), 172–179.https://doi.org/10.15580/GJEMPS.2013.4.060413652
Khayatzadeh J, & Abbasi E. (2010). The 1st International Applied Geological Congress: The Effects of Heavy Metals on Aquatic Animals.
More T.G., R. R. (2003). Impact of heavy metals on DNA content in the whole body of freshwater bivalve. Environmental Science and Pollution Research.
pH in Drinking-water Background document for development of WHO Guidelines for Drinking-water Quality. (2003).
Rivera Uria, M.Y. et. al. (2020). Boletín de la Sociedad Geológica Mexicana. Carbonatos pedogénicos para el tratamiento del drenaje ácido de mina (DAM). Experimentos de laboratorio. http://dx.doi.org/10.18268/BSGM2020v72n1a250919
Sanchez España et. al. (2005). Área de Ingeniería Geoambiental. Dirección de Recursos Minerales y Geoambiente. Instituto Geológico y Minero de España (IGME). The Tintillo acidic river (Rio Tinto mines, Huelva, Spain): an example of extreme environmental impact of pyritic mine wastes on the environment or an exceptional site to study acid-sulphate mine drainage systems.
Sangita, G. U., & Prasad, B. (2010). Studies on environmental impact of acid mine drain. Indian Journal of Environmental Protection, 30(11), 953–966.
Schofield, C. L. (1976). Acid Precipitation: Effects on Fish. In Source: Ambio (Vol. 5, Issue 5).
Shabalala & Ekolu (2019). Department of Civil Engineering Science, University of Johannesburg & University of Mpumalanga, South Africa. Quality of water recovered by treating acid mine drainage using pervious concrete adsorbent. https://doi.org/10.17159/wsa/2019.v45.i4.7545
Sun, J., Tang, C., Wu, P., Strosnider, W. H. J., & Han, Z. (2013). Hydrogeochemical characteristics of streams with and without acid mine drainage impacts: A paired catchment study in karst geology, SW China. Journal of Hydrology, 504, 115–124. https://doi.org/10.1016/j.jhydrol.2013.09.029
Verburg, Rens. Golder Associates, Inc.. SME Mining engineering handbook. Chapter 16.5: Mitigating Acid Rock Drainage. pgs. 1721 – 1732