3.2 Propiedades del agua
- El agua es el único líquido abundante en la superficie de nuestro planeta.
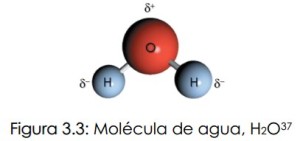
- La molécula de agua es angular y tiene la particularidad de ser polar, debido a que su átomo de oxígeno mantiene una densidad electrónica que lo hace parcialmente negativo, mientras que los átomos de hidrógeno tiene una carga parcialmente positiva, como se muestra en la Figura 3.3. Esta característica hace que las moléculas se “ordenen” y le confieran propiedades muy peculiares, como por ejemplo tener puntos de fusión y de ebullición elevados, al compararlos con los de moléculas análogas de mayor masa y tamaño. Esto explica además, porqué el agua, a pesar de ser una molécula tan pequeña, es líquida a temperatura ambiente.
- El agua líquida es considerada como el disolvente universal porque es capaz de disolver a diferentes tipos de sustancias. Esta característica la convierte en el medio más propicio para que se produzcan las reacciones del metabolismo. Es miscible, en distintas proporciones, con muchos otros líquidos. Por ejemplo, con el alcohol es miscible en todas las proporciones. Sin embargo hay algunas sustancias, como los aceites, que son inmiscibles con el agua. Por otro lado, el vapor de agua es totalmente miscible con el aire y otros gases.
- El agua sólida (hielo) es menos densa que el agua líquida porque al congelarse, las moléculas se acercan entre sí sólo hasta cierta distancia, al formar los denominados puentes de hidrógeno (Figura 3.4). Este hecho hace que entre las moléculas queden espacios vacíos y de esa manera se incrementa su volumen. En consecuencia se observa que el hielo flota sobre el agua líquida. Esta característica permite que sobrevivan los peces y otros organismos acuáticos, porque en las zonas muy frías el agua sólo se congela en la superficie, de modo que esta capa de hielo sirve de aislante térmico. Sin embargo, cuando el agua se congela dentro de los tejidos vivos, su expansión rompe y mata las células. Cuanto más lento se produce el enfriamiento, mayor es el tamaño de los cristales de hielo y en consecuencia, mayor es el daño que se produce en las células.

- El agua líquida es más densa que la mayoría de los otros líquidos comunes, por lo que aquellos que son menos densos y además insolubles en ella, flotan sobre su superficie. Así por ejemplo, cuando se producen grandes derrames de petróleo, éste flota sobre el agua y luego va a dar a las playas, donde ocasionan considerables daños ecológicos, en especial a la fauna marina, como se aprecia en la Figura 3.5. por otro lado, también se dificulta enormemente el poder recoger el petróleo derramado.

- El agua posee elevada capacidad calorífica, lo que significa que para que la temperatura del agua se eleve un grado, necesita absorber mucho calor, en comparación
con otras sustancias semejantes. Esto se debe a que se requiere una mayor cantidad de energía para romper los puentes de hidrógeno. Por esta razón el agua se calienta y se enfría más lentamente que la tierra y por la noche, cuando la tierra ha pedido todo su calor, el agua todavía lo conserva y lo desprende lentamente suavizando así las temperaturas de las zonas costeras. De esta manera, las grandes cantidades de agua presentes en la superficie terrestre actúan como un
gigantesco termostato, para moderar las variaciones diarias de temperatura.
- El agua posee elevado calor de vaporización, lo que quiere decir que para que un gramo de agua pase al estado vapor, necesita absorber una cantidad de calor bastante alta, debido a la presencia del enlace de hidrógeno entre sus moléculas. Esta propiedad, junto con la capacidad calorífica, hacen que el agua modere las temperaturas terrestres, reconduciendo grandes variaciones de energía. Mediante esta propiedad es que podemos disipar grandes cantidades de calor corporal, mediante la evaporación de pequeñas cantidades de agua a través del sudor. También permite que los lagos y los océanos, puedan regular el clima, ya que una fracción importante de calor que elevaría la temperatura, se usa para evaporar agua de la superficie del lago o mar.
- El agua del suelo sube desde la raíz hacia las partes superiores de las plantas debido a la capilaridad. Esta propiedad se define como la capacidad que tiene un
líquido para ascender por un tubo muy estrecho, en contra de la gravedad. La capilaridad se produce debido a las fuerzas de adhesión (fuerza de atracción entre moléculas de distintas sustancias) y cohesión (fuerza de atracción entre las moléculas de una misma especie), que en el caso del agua son altas.1


