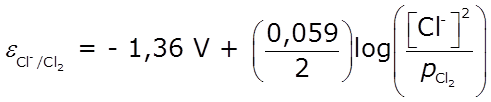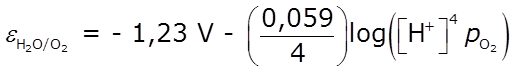4.3.3. Electrólisis de soluciones acuosas
Electrólisis de disoluciones acuosas
Cuando se usa una solución acuosa en una celda electrolítica, debemos considerar si es el agua o el soluto el que se va a oxidar o reducir. En este caso la electrólisis es más complicada porque están involucradas mas especies que pueden ser oxidadas o reducidas.
Sabemos que el agua se puede oxidar para formar O2 o reducir para formar H2, por lo que si analizamos el caso del NaCl(ac), tenemos que el H2O, el Na+ y el Cl–, pueden sufrir oxidación o reducción. Así observamos que no se puede preparar sodio por electrólisis de soluciones acuosas de NaCl ya que el agua se reduce con mas facilidad que el Na+(ac).
Las posibles reacciones catódicas serán la reducción del ión Na+ y del H2O:
La reacción que se llevará a cabo será aquella que requiera un menor potencial para su reducción, en consecuencia se descarta la reducción del Na+ y se observa la producción de H2(g), con la producción de un medio básico y la formación de NaOH(ac) al final de la electrólisis.
Las posibles reacciones anodicas serán la oxidación del Cl– y del H2O:
![]()
Se debe producir la reacción que requiera el menor potencial de oxidación, es decir, se debería favorecer la oxidación del agua, sin embargo observamos que los valores de los potenciales de reducción son bastante cercanos y en consecuencia, esta regla no se cumple en algunas celdas electrolíticas, debido más bien a factores cinéticos que a termodinámicos. Así, se encuentra que ciertos electrodos favorecen la oxidación de Cl–(ac) y forman Cl2(g), en vez de realizarse la oxidación de agua con la producción de O2(g).
En los casos donde intervienen factores cinéticos, se debe aplicar un potencial adicional, denominado sobrevoltaje, que permita la oxidación del agua a O2(g).
Además de los factores cinéticos, la electrólisis también está influenciada por la cantidad de los agentes (oxidantes o reductores) presentes.
Bajo condiciones no estándar, la concentración o la presión, de las especies presentes alteran los potenciales necesarios para la electrólisis. Por ejemplo, al comparar nuevamente la posible oxidación de Cl– o del agua en la misma solución, se expresan tales oxidaciones mediante las siguientes ecuaciones de Nernst:
Observamos que si la solución contiene una concentración muy baja de Cl–, el potencial requerido para la oxidación de Cl–, será mayor que 1,36 V, por lo tanto, se favorecería la oxidación del agua.
Por el contrario, si se emplea una solución muy concentrada de Cl–, se logra disminuir el valor del potencial requerido, y en este caso se observa la oxidación del Cl– a Cl2(g).
 |
Ejercicio
Explica brevemente cómo comprobarías experimentalmente, la diferencia entre los productos de la electrólisis de una solución diluida y otra saturada de NaCl. |
 |
Ejercicio
Explica brevemente cuáles serían los productos de la electrólisis de una disolución acuosa de sulfato de sodio, Na2SO4, justifica tu respuesta. |