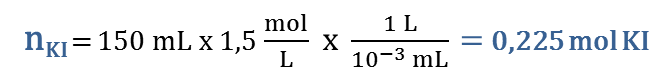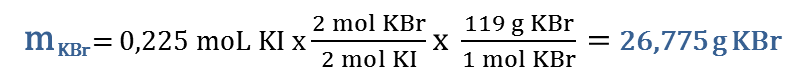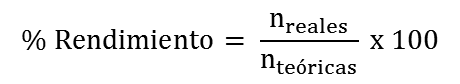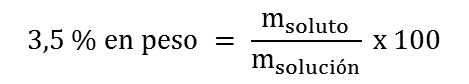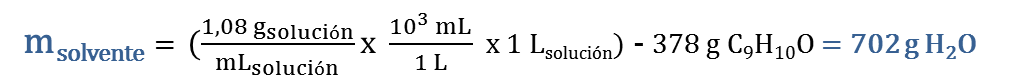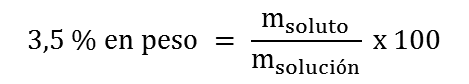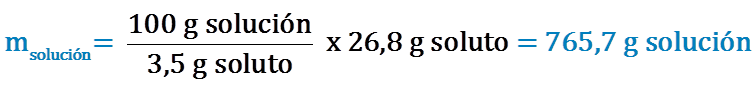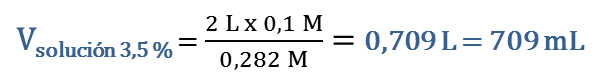Estequiometría y soluciones
En las reacciones químicas, no todos los reactivos y productos se encuentran en una misma fase, usualmente participan sólidos, líquidos, gases y otras sustancias en disolución. Como sabemos, los coeficientes estequiométricos nos indican la proporción de moles con las que participa cada reactivo o se forma cada producto, por ello es importante que sepamos identificar las moles de los reactivos que participan y su relación con las moles de los productos, independientemente del estado de agregación en el que participan.
En esta sección encontrarás algunos problemas resueltos que son guiados paso a paso para tu mejor comprensión y luego podrás resolver los propuestos.

|
Problema 1
Un forma de obtener I2 sólido es a través de la reacción del bromo, Br2, con solución acuosa de KI, según la reacción: Br2(l) + KI(ac) → KBr(ac) + I2(s)
Si se hacen reaccionar 0,25 moles de Br2(l) con 150 mL de solución acuosa 1,5 M de KI, determina la masa de KBr que se produce.
|
| Solución 1
Cuando trabajamos estequiometría, lo primero que debemos hacer es balancear la ecuación dada: Br2(l) + 2 KI(ac) → 2 KBr(ac) + I2(s) Luego calcularemos las moles disponibles de cada reactivo:
Conocido el reactivo limitante, procedemos a determinar la cantidad del producto solicitado, haciendo uso de los factores estequiométricos: |
|
 |
Problema 2
El aceite de cinamon, obtenido de las ramas y hojas de árboles de canela que crecen en las zonas tropicales, se utiliza en la producción de perfumes y cosméticos. Su constituyente principal es el aldehído cinámico, C9H8O, sin embargo una concentración elevada de éste ocasiona severas irritaciones en la piel, por lo que las concentraciones presentes en los perfumes deben ser bajas. Con la finalidad de evitar irritaciones en la piel se buscó un derivado del aldehído cinámico, de fórmula C9H10O, con propiedades similares, pero que no causa irritaciones a la piel. Éste se prepara haciendo reaccionar aldehído cinámico, C9H8O, con hidrógeno gaseoso, H2, según la reacción: C9H8O(ac) + H2(g) → C9H10O(ac) Para obtener el derivado, C9H10O, se hacen reaccionar 15 L de solución de aldehído cinámico 3,5 M con 30,7 moles de hidrógeno gaseoso. Determina lo siguiente:
|
| Solución 2
1. Primero, verificamos si la ecuación está balanceada: C9H8O(ac) + H2(g) → C9H10O(ac) Luego determinamos las moles disponibles de cada uno de los reactivos:
2. Primero determinamos la masa del soluto, C9H10O, que se requiere para preparar 1 L de solución acuosa 3,5 % en peso:
Finalmente, para preparar 1 L de la solución al 3,5 % en peso se deben pesar 378 g de C9H10O y disolverlos en 702 mL de agua.
3. Como sabemos, los problemas no tienen una única vía de solución, por lo que vamos a enfocar el problema desde dos puntos de vista. Determinamos primero cuántas moles del soluto C9H10O deben estar contenidos en los 2 L de solución 0,1 M y luego qué masa le corrresponde:
Luego, como se trata de hacer una dilución, las moles de C9H10O requeridas de la solución al 3,5 % en peso o 0,282 M, serán las mismas que estarán presentes en la nueva solución 0,1 M, es decir, nsoluto en solución al 3,5 % = nsoluto en solución 0,1 M De donde determinamos el volumen de solución al 3,5 % en peso que se requiere para preparar la nueva solución 0,1 M: |
|