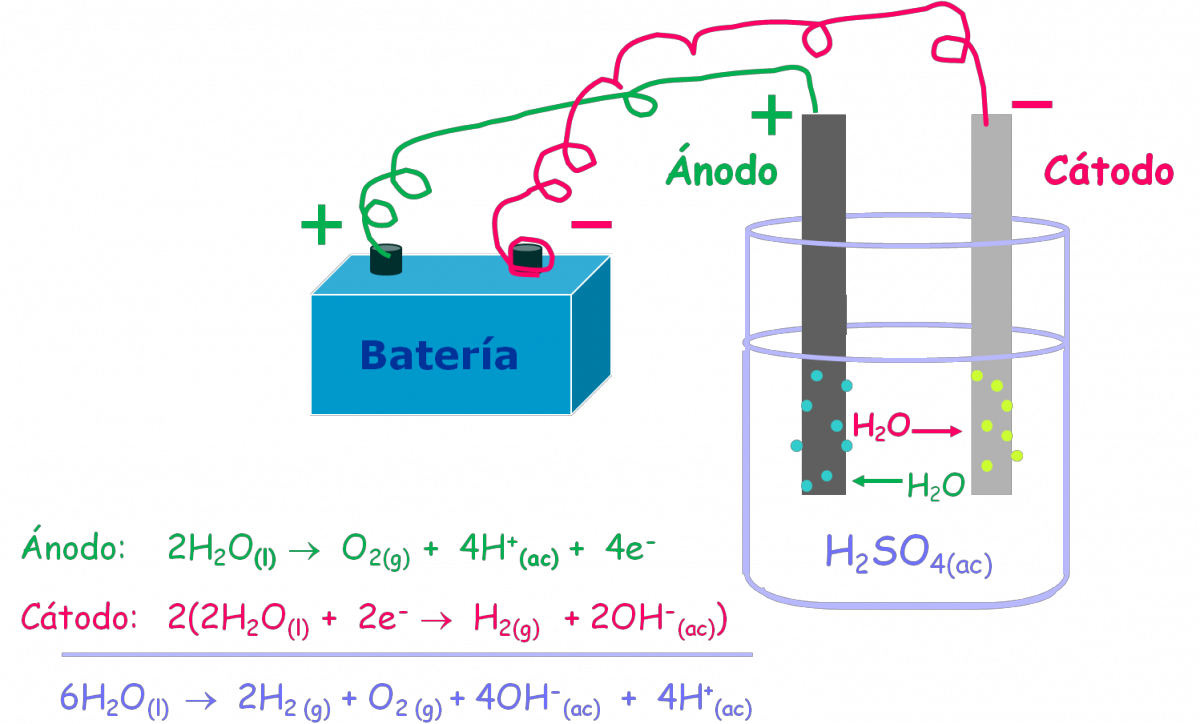
4.3.2. Electrólisis del agua
Electrólisis del agua
El agua en condiciones atmosféricas, 1 atm y 25 ºC, no se descompone de manera espontánea (energía libre de Gibbs = 474,4 kJ) para formar H2(g) y O2(g). Si embargo, esta reacción se puede inducir en una celda electrolítica como se muestra en la figura anterior. Pero cuando los electrodos se sumergen en agua pura y se conectan a la batería no sucede nada porque no hay suficientes iones (recordemos que a 25 ºC [H+] = 10–7 M y [OH–] = 10–7 M) que transporten una buena cantidad de corriente eléctrica.
Para que la reacción se pueda llevar a cabo rápidamente, se usa por ejemplo, una disolución 0,1 M de H2SO4, porque en ella hay suficiente cantidad de iones para conducir la electricidad. De inmediato empiezan a aparecer burbujas de gas de hidrogeno y oxígeno en los dos electrodos, sin que haya consumo neto del ácido sulfúrico.
Las reacciones correspondientes son:
Ánodo: 2 H2O(l) → O2(g) + 4 H+(ac) + 4 e–
Cátodo: 2 [2 H+(ac) + 2 e– → H2(g)]
___________________________________
2 H2O(l) → 2 H2(g) + O2(g)
El siguiente video nos muestra brevemente cómo se produce la electrólisis del agua: