4.3.1. Electrólisis de sales fundidas
Electrólisis de sales fundidas
- Las sales, por tratarse de compuestos iónicos, funden a altas temperaturas.
- Las sales en estado fundido tienen la capacidad de transportar corriente.
- Por ejemplo de sal que usamos en la cocina, NaCl(s), en el estado fundido estará como:
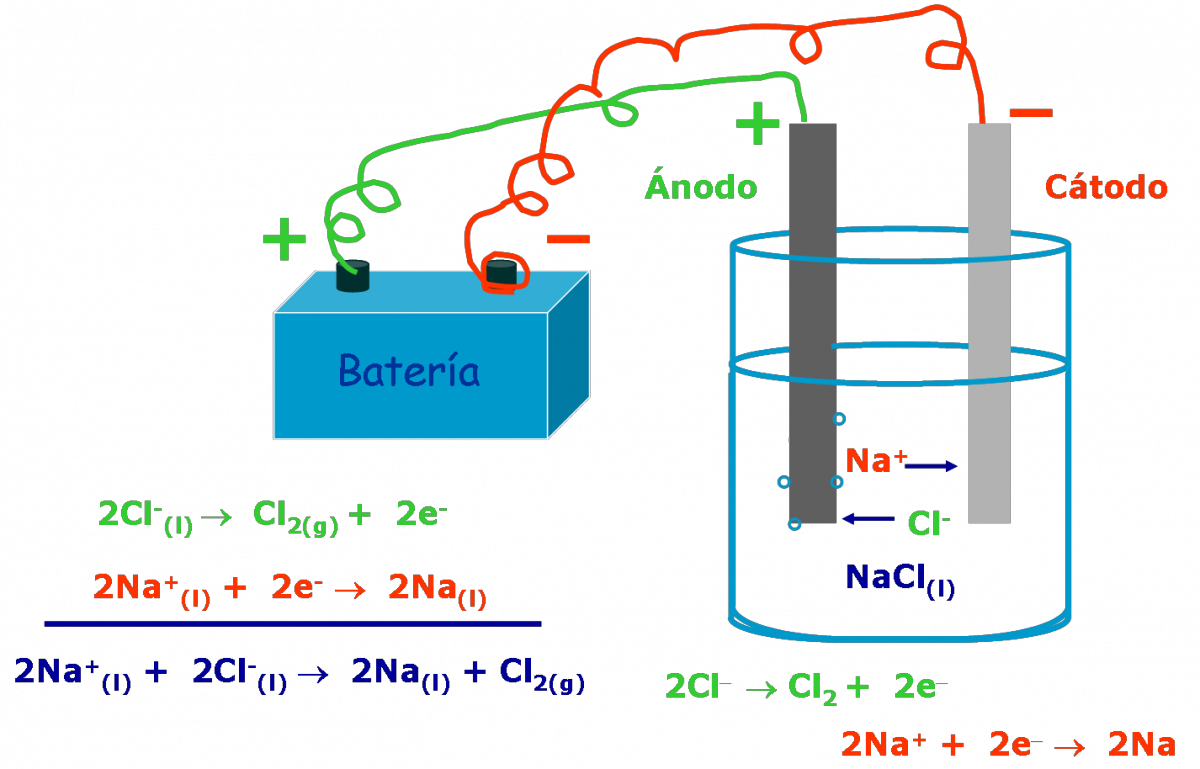
- Al pasar una corriente eléctrica, a traves de una sal fundida observaremos que:
- los cationes Na+ se desplazan hacia el cátodo donde se reducen.
 |
Observación
Al igual que las celdas galvánicas, el electrodo donde se produce la reducción se llama cátodo y el electrodo donde ocurre la oxidación es el ánodo. |
Así en el caso del NaCl fundido tenemos:
Cátodo: 2 Na+(l) + 2 e– → 2 Na(l)
Ánodo: 2 Cl–(l) → Cl2(g) + 2 e–
_________________________________
2 Na+(l) + 2 Cl–(l) → 2 Na(l) + Cl2(g)
 |
Las electrólisis de sales fundidas aplicada en la producción de metales activos como el sodio, Na, y aluminio, Al, son procesos industriales importantes. |
El siguente video nos muestra una animación de lo que sucede durante el proceso de electrólísis del NaCl fundido: