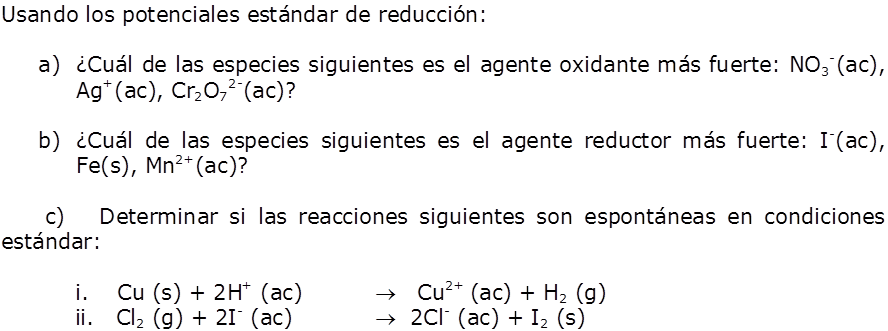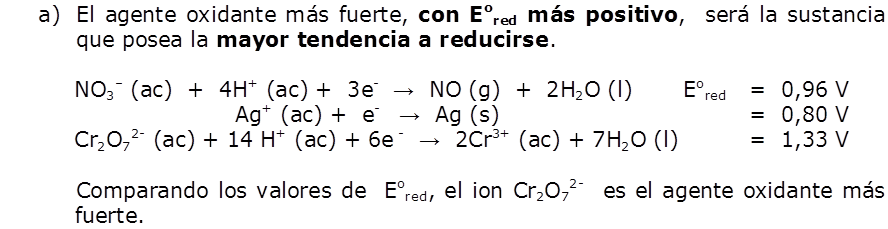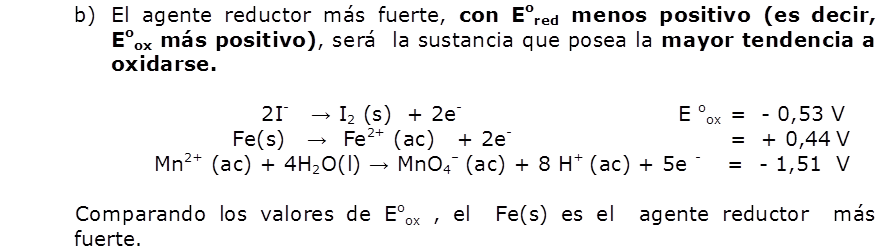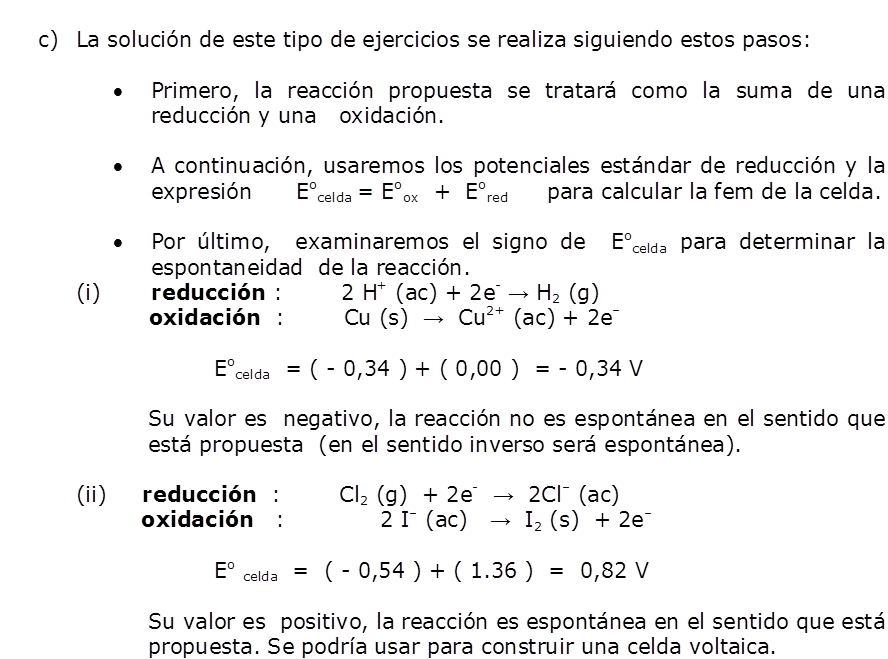4.2.2 Agentes oxidantes y reductores
Hasta este punto hemos empleado los potenciales estándar de reducción, como una herramienta para examinar celdas voltaicas.
También, podemos usar los valores de Eored, como una ayuda valiosa para entender la química de las reacciones acuosas y generalizar la relación entre el valor de Eored y la espontaneidad de la reducción redox.
Un examen de las medias reacciones de la tabla muestra que:
a) F2 es la especie que se reduce con más facilidad y es por tanto el agente oxidante más fuerte:
F2 (g) + 2e– → 2F– (ac) Eored = 2,87 V
b) El ion Li+ es la especie que se reduce con más dificultad y es por tanto el agente oxidante más débil:
Li+ (ac) + e– → Li (s) Eored = -3,05 V
Cuanto más positivo es el valor de Eored de una media reacción, mayor es la tendencia del reactivo de la media reacción a reducirse y, por consiguiente, a oxidar a otra especie.
Vemos que la lista de valores de Eored proporciona un orden, de acuerdo con la capacidad de las sustancias, para actuar como agentes oxidante o reductores; esta relación se resume en la figura siguiente:
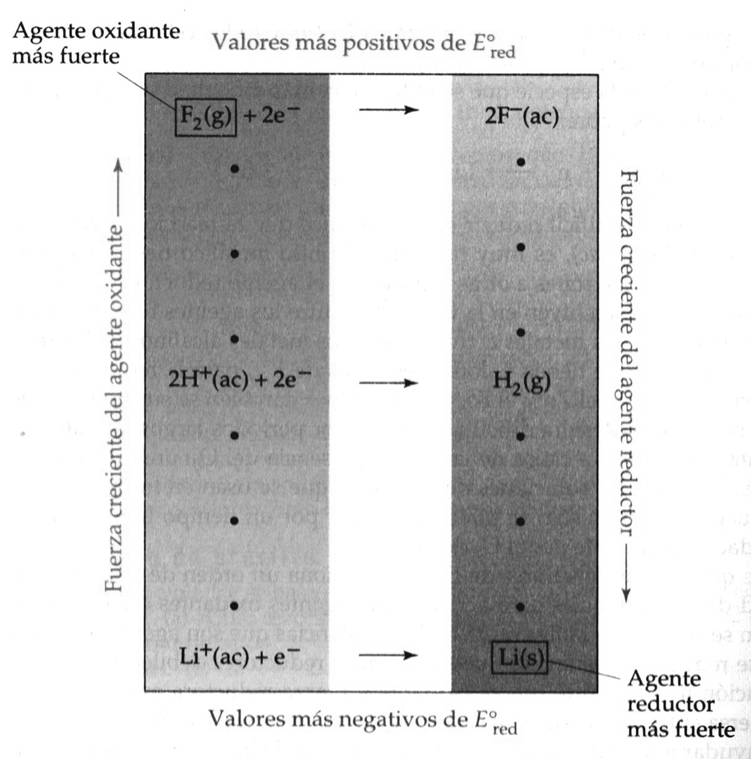 Capacidad de las sustancias para actuar como agentes oxidantes o reductores
Capacidad de las sustancias para actuar como agentes oxidantes o reductores