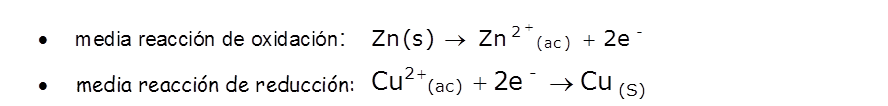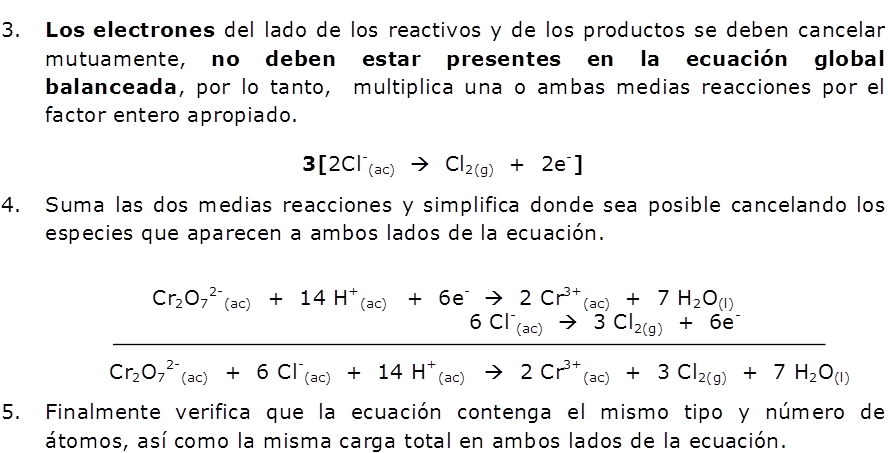4.1.1 Balance de reacciones redox
Reacciones Óxido-Reducción (REDOX)
Las reacciones de oxidación-reducción forman una parte importante del mundo que nos rodea. Abarcan desde la combustión de combustibles fósiles hasta la acción de los blanqueadores de ropa domésticos. Asimismo, la mayoría de los elementos metálicos y no metálicos se obtienen de sus minerales por procesos de oxidación o de reducción. Hay muchos fenómenos que se dan a tu alrededor y en tu propio cuerpo relacionados con la química de los procesos de oxidación y reducción. Así, por ejemplo, los objetos metálicos se oxidan cuando están a la intemperie; al encender una estufa (no eléctrica) se produce calor por la oxidación del combustible; en tu propio cuerpo, las células oxidan las sustancias nutritivas presentes en los alimentos para obtener la energía que te permite vivir. Hay procesos biológicos tan importantes como la fotosíntesis y la respiración celular que en esencia serán reacciones redox. El primero involucra la reducción del dióxido de carbono atmosférico para producir glucosa, un compuesto altamente energético; el segundo, en cambio, oxida este monosacárido y libera la energía contenida en sus enlaces.
Las reacciones de oxidación -reducción se deben, principalmente, a la transferencia de electrones desde un agente reductor a un agente oxidante.
En una reacción REDOX u óxido reducción, una especie se oxida (cede electrones) y la otra especie se reduce (gana electrones). Como estas dos situaciones ocurren en la misma reacción, los electrones cedidos por la especie que se oxida, son empleados por la especie que se reduce, que debe ganar electrones.
Ejemplo de una reacción REDOX:
Cuando, se introduce una lámina de zinc, en una disolución concentrada de iones Cu2+, al cabo de unos segundos, ésta se recubre de una capa de cobre metálico.
La ecuación química que representa el proceso es:
La ecuación anterior nos indica, que durante el proceso, el átomo de zinc se ha transformado en el ion Zn2+, para lo cual ha tenido que ceder dos electrones; en cambio, el ion Cu2+ se ha convertido en un átomo de cobre, para lo cual ha debido aceptar dos electrones.
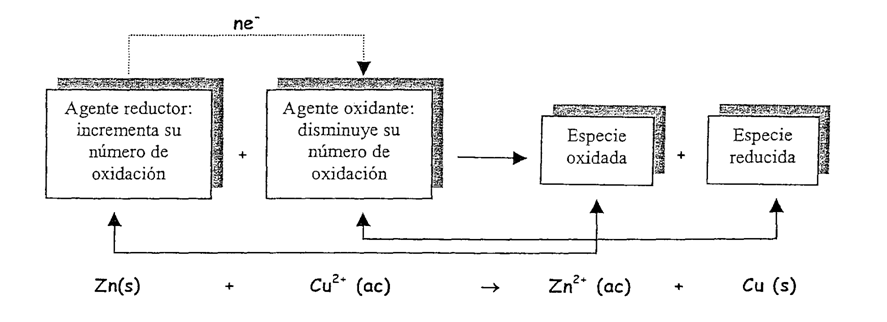
Sobre la base de esta información deducimos que la ecuación iónica anterior involucra dos procesos:
• En uno, se pierden electrones, y
• En el otro, se ganan electrones.
Las ecuaciones que describen estos procesos son:
Por lo tanto, en el proceso de oxidación un átomo o un ion cede uno o más electrones; mientras que en el proceso de reducción, el átomo o el ion capta uno o más electrones. Ambos procesos son complementarios y ocurren simultáneamente.
En toda reacción REDOX, se tiene:
- un agente oxidante
- un agente reductor
- una especie oxidada
- una especie reducida
En las ecuaciones REDOX, el agente oxidante y el agente reductor, se encuentran siempre como reactantes; mientras que la especie oxidada y la especie reducida, se encuentran siempre como producto.
Agente oxidante
En toda reacción redox, el agente oxidante es la especie química que se reduce, es decir, la que recibe los electrones. Tengan en cuenta, que en la semir-reacción de reducción, se consumen los electrones.
En la ecuación, observamos que el ion cobre (Cu2+) se reduce, porque recibe los electrones que provienen del zinc y se convierte en cobre elemental, Cu(s) eléctricamente neutro.
Por lo tanto el ion Cu2+ es el agente oxidante.
Agente Reductor
En toda reacción redox, el agente reductor es la especie química que se oxida, es decir, la que cede electrones. Tengan en cuenta que en la semi-reacción de oxidación, se producirán electrones.
En la ecuación, el Zn(s) es el agente reductor, ya que en la semireacción se producen electrones, lo que significa que el zinc se oxida y se transforma Zn2+.
Por lo tanto el Zn, es el agente reductor.
Especie Oxidada
Será la especie que recibió los electrones, en nuestro ejemplo el Zn2+.
Especie Reducida
Será la especie que perdió los electrones, en nuestro ejemplo el Cu.
 |
Ejercicio |
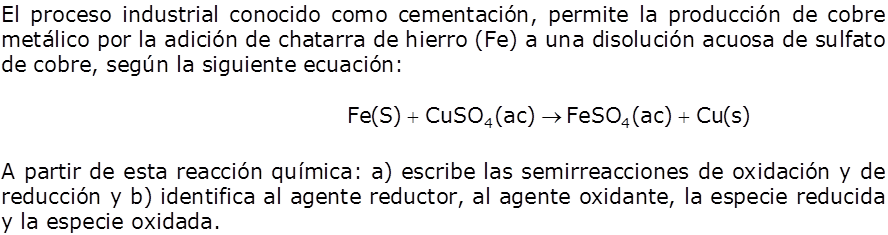 |
Balance de Ecuaciones Redox por el Método Ion -Electrón
El método del ion electrón es empleado para encontrar los coeficientes estequiométricos de una reacción redox; dado que considera a las especies químicas tal como existen en una disolución acuosa, ya sea en forma iónica o molecular, así como el medio (ácido: H+ o básico: OH–) en el que ocurre la reacción.