4.1 Introducción
La energía eléctrica y los procesos químicos
Todos estamos familiarizados, conocemos o hemos escuchado sobre cualquiera de las dos situaciones que describimos a continuación.
Situación 1
Si tenemos, un celular, una laptop, un i-phone, etc. nos preocupemos diariamente de poner a “cargar” estos artefactos. Para ello conectamos, la batería de los equipos, a la corriente eléctrica, una vez cargada, nos proporciona la energía necesaria, para que podemos utilizarlos durante el día. También utilizamos “pilas” para nuestras cámaras fotográficas, para los comandos del Wi, estas son de una forma diferente a las “pilas” que empleamos, para los relojes, o para las calculadoras ¿Qué proceso permite que las baterías proporcionen energía eléctrica?



Situación 2:
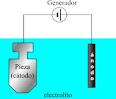
Hemos escuchado términos, como esa joya está bañada en oro, en plata; se conversa o conocemos de piezas niqueladas, que no es otra cosa que un baño de níquel sobre alguna pieza metálica, o del cobre electrolítico que produce Perú en sus refinerías del sur del país. ¿Qué procesos permiten, bañar piezas en oro o en plata, niquelar piezas metálicas o producir cobre electrolítico?
Para cualquiera de las dos situaciones descritas, el proceso es el mismo, se trata de procesos electroquímicos. En la primera situación, el proceso electroquímico genera energía eléctrica, mientras que en la segundo situación, el proceso electroquímico requiere de la energía eléctrica para que pueda producirse.
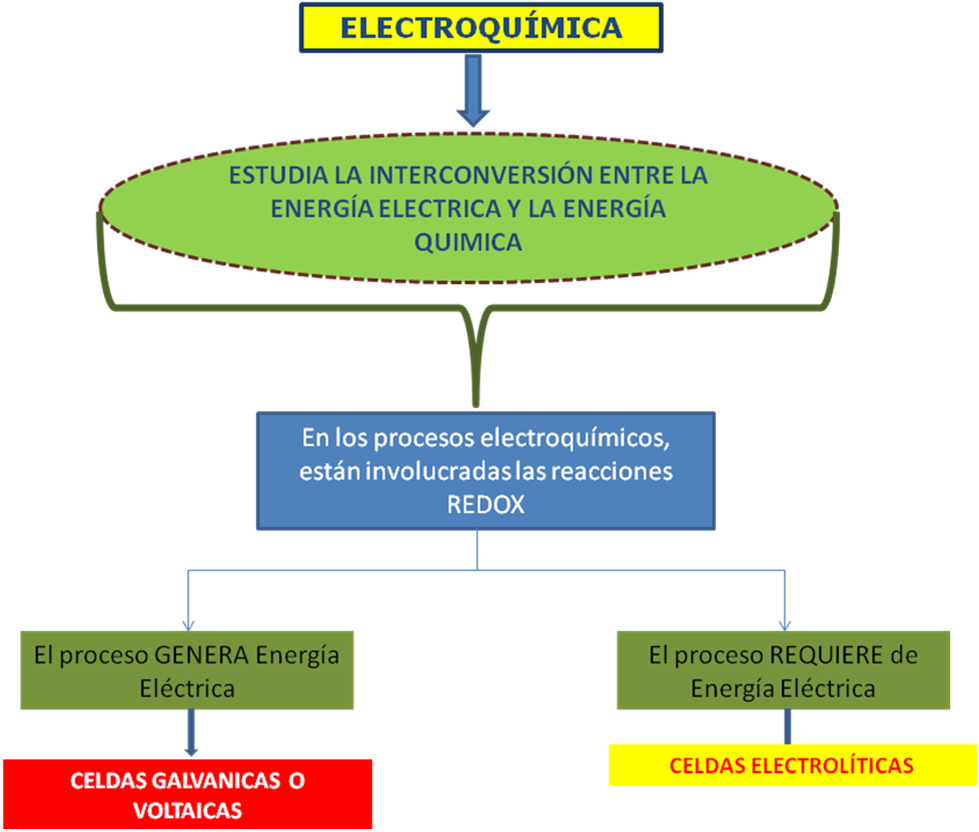
Para poder comprender los procesos electroquímicos, debemos precisar que la electroquímica, es la rama de la química que estudia la conversión entre la energía eléctrica y la energía química. (Chang, 1999).
¿ Cuando se genera un proceso electroquímico?
Cuando ocurre una reacción del tipo redox, (reacciones de óxido-reducción). Como toda reacción química, las reacciones redox, pueden ser espontáneas o no espontáneas.
Cuando la reacción redox es espontánea, la energía liberada en ella, se convierte en electricidad; pero si la reacción redox es no espontánea, será necesario suministrar corriente eléctrica para que la reacción ocurra.
En otras palabras, el campo de la electroquímica se divide en dos partes:
- los procesos electroquímicos que generan energía eléctrica, estos procesos se lleva a cabo, en una celda o pila galvánica.
- los procesos electroquímicos que requieren de energía eléctrica, para que sucedan, estos se llevan a cabo en una celda electrolítica y se conoce industrialmente como electrólisis.
Debemos recordar que, una reacción redox, ocurre por la transferencia de electrones. Estos electrones fluyen del agente reductor hacia el agente oxidante.