3.6.8. Soluciones Buffer o Amortiguadoras
Algunas veces es necesario preparar y guardar una solución con un pH constante. La preservación de dicha solución es aún más difícil que su preparación:
- si la solución entra en contacto con el aire, absorberá dióxido de carbono, CO2, y se volverá más ácida.
- si la solución se guarda en un recipiente de vidrio, las impurezas alcalinas “desprendidas” del vidrio pueden alterar el pH.
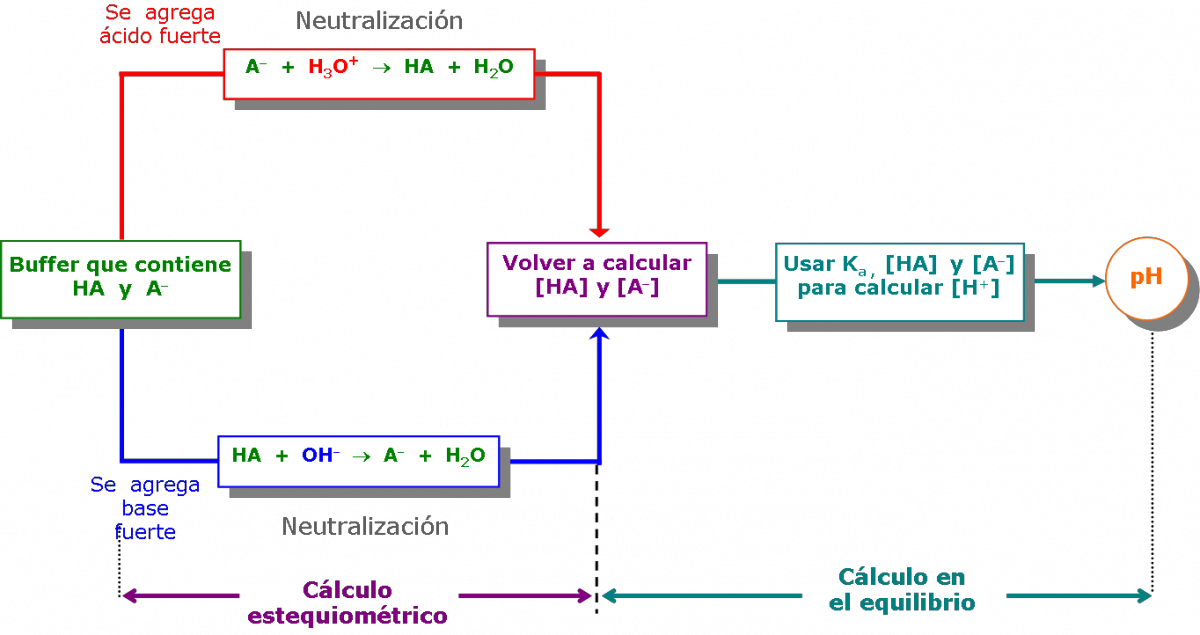
Las soluciones buffer o amortiguadoras son capaces de mantener su pH en valores aproximadamente constantes, aún cuando se agreguen pequeñas cantidades de ácido o base, o se diluya la solución.
Una disolución buffer o amortiguadora se caracteriza por contener simultáneamente una especie débil y su par conjugado:
- un ácido débil y la sal de su par conjugado
- una base débil y la sal de su par conjugado
La disolución buffer debe contener una concentración relativamente grande de cada uno de los integrantes del par conjugado, de modo que:
- la especie ácida del sistema buffer pueda reaccionar con los iones OH– que se le añadan
- la especie básica del sistema buffer pueda reaccionar con la cantidad de iones H+ que se añadan
|
La presencia del par conjugado hace que la especie débil se disocie en menor proporción:
|
|
|
La presencia de la especie débil hace que el par conjugado se hidrolice menos:
|
|
Cómo calcular el pH en soluciones buffer