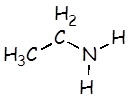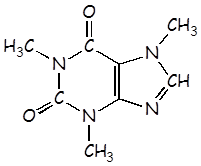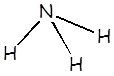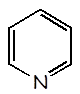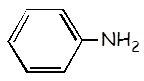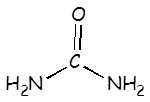3.6.3. Fortaleza de bases
Fuerza de Bases
Los hidróxidos metálicos contienen iones OH– en sus redes cristalinas, luego todos son bases potencialmente fuertes. La fuerza de los hidróxidos está determinada por la concentración de iones OH– en la disolución.
Las bases fuertes están conformadas por los hidróxidos de los metales de las familias 1A y 2A de la tabla periódica (excepto Be y Mg):
| Bases fuertes | 1A | LiOH, NaOH, KOH, RbOH, CsOH, FrOH |
|---|---|---|
| 2A | Ca(OH)2, Sr(OH)2, Ba(OH)2, Ra(OH)2 |
El hidróxido de sodio, NaOH, es una base fuerte, en cambio el hidróxido de magnesio, Mg(OH)2, es débil:
Como observamos, las bases débiles también forman un sistema en equilibrio cuando se disuelven en agua: ![]()
| [ ]0 |
[ ]0 |
— |
— |
|
| [ ]reacciona |
x |
— |
— |
|
| [ ]forma |
— |
x |
x |
|
| [ ]eq |
[ ]0 –x |
x |
x |
La expresión de la constante de equilibrio, en términos de concentraciones, se denomina Kb, constante de disociación básica:
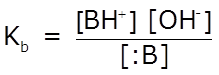 Al observar la expresión de Kb podemos concluir que conforme se incrementa la [OH–], aumentará el valor de Kb y el del grado de ionización, α. Cuanto mayor es el valor de α, la base será menos débil, y en consecuencia, mayor es el valor de Kb.
Al observar la expresión de Kb podemos concluir que conforme se incrementa la [OH–], aumentará el valor de Kb y el del grado de ionización, α. Cuanto mayor es el valor de α, la base será menos débil, y en consecuencia, mayor es el valor de Kb.
 |
Ciertas bases son mejores aceptoras de protones que otras. Cuanto más fuerte es una base, más débil es su ácido conjugado.
A mayor valor de Kb ⇒ menos débil o relativamente más fuerte es la base. |
Constantes de Ionización de algunas Bases Débiles a 25 ºC
|
Nombre |
Fórmula |
Estructura |
Kb |
Ácido conjugado |
|---|---|---|---|---|
|
Etilamina |
C2H5NH2 |
5,6 x 10–4 |
C2H5NH3+ |
|
|
Metilamina |
CH3NH2 |
4,4 x 10–4 |
CH3NH3+ |
|
|
Cafeína |
C8H10N4O2 |
4,1 x 10–4 |
C8H11N4O2+ |
|
|
Amoníaco |
NH3 |
1,8 x 10–5 |
NH4+ |
|
|
Piridina |
C5H5N |
1,7 x 10–9 |
C5H5NH+ |
|
|
Anilina |
C6H5NH2 |
3,8 x 10–10 |
C6H5NH3+ |
|
|
Urea |
H2NCONH2 |
1,5 x 10–14 |
H2NCONH3+ |
El siguiente video te muestra la diferencia de comportamiento entre una base fuerte y una base débil: