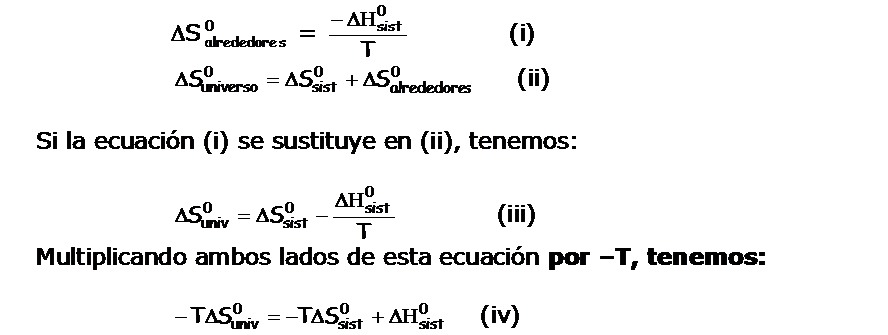1.7.- Energía Libre de Gibbs
Según la segunda ley de la termodinámica, una reacción espontánea hace que se incremente la entropía del universo. Por lo tanto se debe calcular la variación de la entropía del sistema y la de los alrededores. Por lo general nos interesa sólo lo que ocurre en el sistema en particular y, por otro lado el cálculo de la variación de la entropia de los alrededores puede resultar muy difícil.
Fue necesario encontrar, por tanto, otra función termodinámica, que permitiera determinar si una reacción ocurre de manera espontánea considerando sólo al sistema mismo.
Siguiendo el siguiente razonamiento:
Por lo tanto si queremos analizar la espontaneidad de una reacción, debemos forzar a que la variación de la Energía libre de Gibbs sea menor a cero (negativa).
Analicemos la tabla siguiente:
 Cambios de energía Libre de Gibbs a condiciones estándar
Cambios de energía Libre de Gibbs a condiciones estándar
La energía libre estándar de reacción
es el cambio de energía libre en una reacción cuando ocurre en condiciones estándar, cuando los reactivos en su estado estándar se convierten en productos en su estado estándar.
La siguiente tabla resume las convenciones utilizadas por los químicos para definir los estados estándares de sustancias puras y de las disoluciones:
Para una reacción química genérica:
a A + b B → c C + d D
La variación de la energía libre de Gibbs a condiciones estándar
se calcula de la manera siguiente:
 |
Los valores de energía Libre de Gibbs a condiciones estandar los puedes hallar en el siguiente enlace: http://physics-of-molecules.odessit.org/library/db/thermodata_2400.pdf |