5.4. Propiedades de los líquidos
Una vez conocidos los tipo de fuerzas intermoleculares podemos analizar y explicar las propiedades de los líquidos:
- tensión superficial
- capilaridad
- viscosidad
- presión de vapor
- punto de ebullición
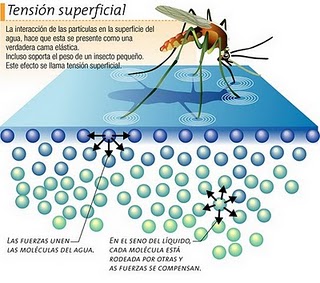
Tensión superficial
Después de un día de lluvia o cuando has regado tu jardín, es fácil observar imágenes como las mostradas a continuación:

|

|
 |
Ejercicio
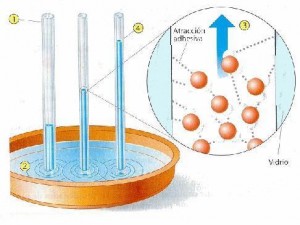
El menisco se define como la superficie libre, cóncava o convexa, del líquido contenido en un tubo estrecho. Explica brevemente, por qué el agua forma un menisco cóncavo y el mercurio un menisco convexo, en el interior de un tubo de vidrio. |
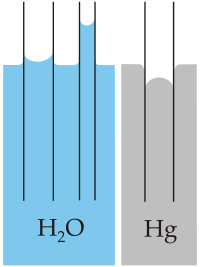
Wikipedia: MesserWoland |
Viscosidad
- Cuanto mayores son las fuerzas intermoleculares de un líquido, sus moléculas tienen mayor dificultad de desplazarse entre sí, por lo tanto la sustancia es más viscosa.
- Los líquidos que están formados por moléculas largas y flexibles que pueden doblarse y enredarse entre sí, son más viscosos.
 |
Recuerda
La viscosidad aumenta a medida que aumentan las fuerzas intermoleculares. |
El siguiente video te muestra una medición de las viscosidades realizada por alumnos de Mecánica de Fluidos:
 |
Ejercicio
Justifica brevemente cómo esperas que varíe la viscosidad con la temperatura. |
Presión de vapor
Sabemos que las moléculas pueden escapar de la superficie de un líquido, hacia la fase gaseosa, por vaporización o evaporación y ademas, que hay sustancias que se evaporan más rápidamente que otras, ¿de qué depende esta diferencia?
La explicación está en las fuerzas intermoleculares:
- si las moléculas del líquido poseen una mayor intensidad de fuerza intermolecular, entonces quedarán atrapadas en el líquido y tendrán menor facilidad para pasar a la fase gaseosa.
- por el contrario a menor intensidad de fuerza intermolecular, entonces las moléculas podrán escapar más fácilmente al estado gaseoso.
Este análisis nos permite definir:
- volatilidad, una sustancia será más volátil cuando se evapore más fácilmente, es decir cuando posea menores fuerzas intermoleculares.
|
http://www.sabelotodo.org/termicos/ imagenes/presionvapor.gif |
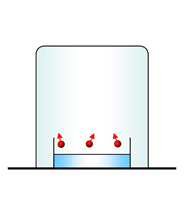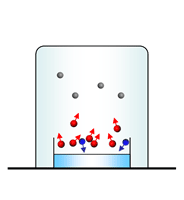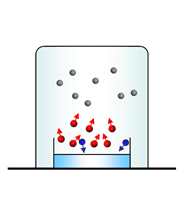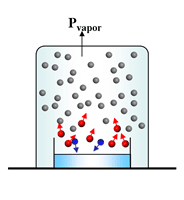
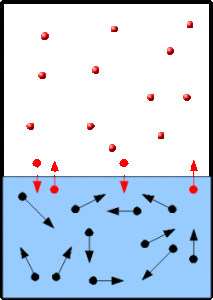
Cuando la velocidad de las moléculas que abandonan la superficie del líquido (evaporación) es igual a la velocidad de las moléculas que regresan al líquido (condensación), se establece un equilibrio dinámico. En este momento ya no se modifica la cantidad de moléculas en el estado vapor.
El vapor ejerce entonces una presión constante conocida como presión de vapor del líquido.
La presión de vapor de un líquido depende de la temperatura: a mayor T, mayor es la Pvapor.
|
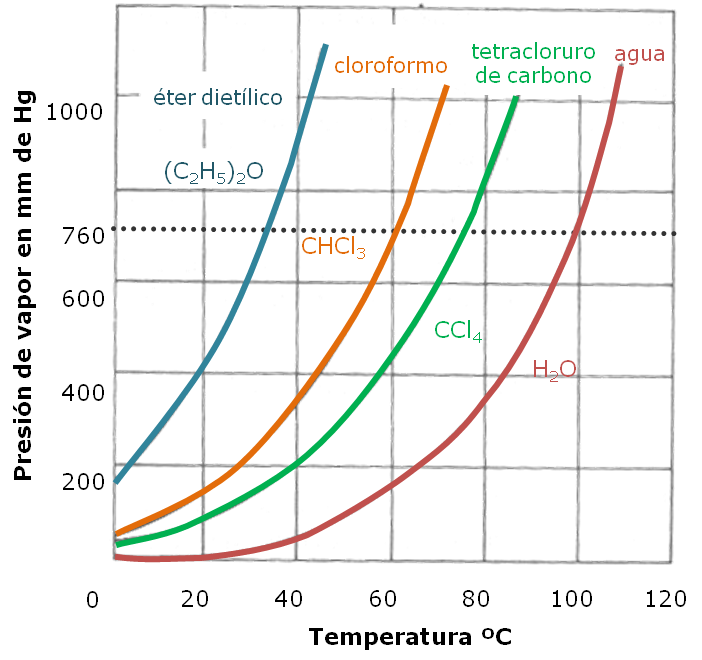
A continuación te presentamos las curvas de presión de vapor de algunas sustancias:
Punto de ebullición
El punto de ebullición de un líquido es la temperatura a la cual la presión de vapor del líquido es igual que la presión ejercida sobre el líquido, (presión atmosférica).
 |
Ejercicio
Justifica dónde hierve el agua a menor temperatura, en Lima, en el Cuzco o en Ticlio. |
- Calor de vaporización, es una medida de la intensidad de las fuerzas intermoleculares que se ejercen en un líquido. Se define como la cantidad de calor necesario para pasar una cantidad de una sustancia, del estado líquido al estado gaseoso, a la temperatura de ebullición.
 |
Ejercicio Analiza las fuerzas intermoleculares estudiadas y relaciona sus intensidades con las de las propiedades físicas que se indican, completa el siguiente cuadro y justifica brevemente tus respuestas:
|
|||||||||||||||||||||||