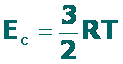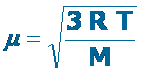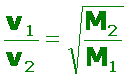5.2.3. Teoría Cinético Molecular – Ley de Graham
Teoría Cinético Molecular
El estudio del comportamiento de los gases está basado en las leyes estudiadas previamente y se explica mediante la teoría cinético molecular, la cual fue enunciada por el físico alemán Rudolf Clausius, que establece lo siguiente:
- Los gases están formados por partículas muy pequeñas llamadas moléculas. Las distancias entre ellas son muy grandes, en comparación con sus diámetros, de modo que se considera que las moléculas poseen masa pero tienen volumen despreciable.
- Las moléculas de un gas se mueven constantemente, en todas direcciones y al azar, además los choques ocolisiones son elásticos. No todas las moléculas se mueven con la misma velocidad, las cuales son muy altas. Por ejemplo, la velocidad media de una molécula de hidrógeno, H2, a 25 °C es de 1768 m.s-1, casi 6400 km/hora. En consecuencia, poseen energía cinética, Ec:
EC = ½ m υ2
donde: m es la masa de la molécula gaseosa
υ es la velocidad promedio con la que se desplaza
- No existen fuerzas de atracción ni repulsión entre las moléculas de un gas ideal, ni entre éstas y su recipiente. Por lo tanto, cuando una molécula choca contra otra, la energía se transfiere de una a otra pero la energía total de todas las moléculas permanece sin cambio.
- La energía cinética de las moléculas es proporcional a la temperatura del gas, en grados Kelvin. Dos gases cualesquiera a la misma temperatura, tendrán la misma energía cinética.
 |
Ejercicio
En base a lo planteado por la teoría cinético molecular, cómo explicarías:
|
Ley de Graham – Difusión y Efusión de Gases
Hemos visto que las moléculas de un gas se mueven de forma aleatoria y constante, con una velocidad promedio que depende de la temperatura a la que se encuentren.
También hemos visto que la velocidad media es inversamente proporcional a la masa de la molécula gaseosa, es decir, a una misma temperatura, una molécula pequeña o “liviana”, se desplazará con mayor rapidez que otra más grande o “pesada”.
Difusión: es el proceso mediante el cual las moléculas de un gas se “esparcen” o difunden a través de otra sustancia o a través del vacío.
Efusión: es el proceso mediante el cual las moléculas de un gas, que se encuentran confinadas en un recipiente, fluyen o “escapan” a través de un agujero pequeño.