3.5. Enlace metálico
Los metales poseen propiedades que los han hecho indispensables para el desarrollo del hombre. En nuestros días, tenemos un contacto diario con los metales, los cuales utilizamos en diversas formas, debido a las propiedades que los caracterizan. Por ejemplo, es muy difícil cortar la carne con un cuchillo de plástico, pero es más fácil con un cuchillo de metal. Por otro lado, calentamos el agua en una tetera metálica, pero no podemos hacerlo eficientemente en una jarra de vidrio.
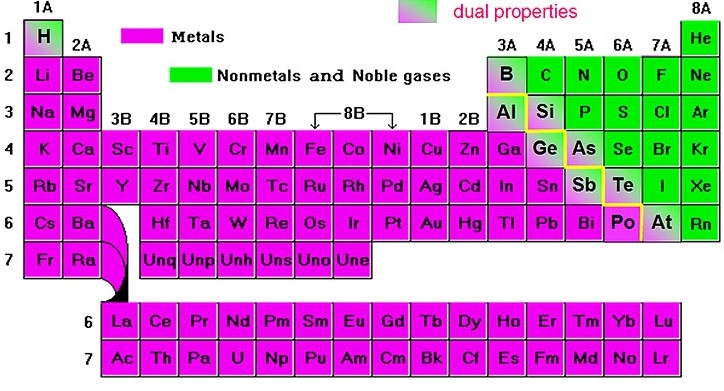
Más de 80 elementos de la tabla periódica son metales. Un metal está formado únicamente por un elemento de la tabla periódica: ejemplos de metales son el hierro (Fe), cobre (Cu) o sodio (Na). La fuerza que mantiene unidos a los átomos de un metal se llama enlace metálico.
Figura 3.6. Elementos de la tabla que son metales (destacados en fucsia).
Tomado de: “Chemistryland” (http://www.chemistryland.com/CHM107/Water/WaterTutorial.htm)
Propiedades de los metales
Los metales tienen las siguientes propiedades:
- Brillo: reflejan el haz de luz.
- Maleabilidad: capacidad de formar láminas.
- Ductilidad: capacidad para ser esturados formando hilos.
- Conductividad térmica: conducen el calor, por eso son fríos al tacto.
- Conductividad eléctrica: movimiento ordenado de electrones frente a un campo eléctrico.
Estas propiedades se explican mediante dos teorías: la teoría del mar de electrones y la teoría de bandas.
Teoría del mar de electrones
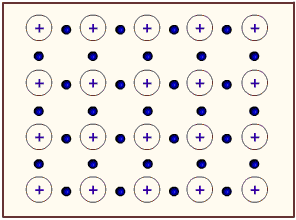
Los metales tienden, por su baja energía de ionización, a perder electrones. Por tanto, podríamos considerar a un átomo metálico como un catión unido al electrón de valencia que podría perder. En un metal tenemos muchísimos átomos unidos entre sí. Entonces, podemos considerar a un metal como un conjunto de cationes metálicos inmersos en un mar de electrones de valencia deslocalizados. La atracción electrostática entre carga positiva (del catión) y negativa (del electrón) mantiene fuertemente unidos a todos los átomos del metal. La siguiente figura muestra un poco la idea del mar de electrones:
Figura 3.7. Modelo del mar de electrones: cationes metálicos inmersos en una gran cantidad de electrones móviles
Tomado de: Tutorvista.com (http://www.tutorvista.com/content/chemistry/chemistry-iii/chemical-bonding/bonding-metallic-solids.php)
Los electrones de valencia deslocalizados actúan como un pegamento electrostático, manteniendo unidos a los cationes metálicos. Es algo similar a lo que ocurre en el enlace iónico, donde ocurre atracción catión-anión. En este caso, ocurre la atracción catión-electrón.
El modelo del mar de electrones explica de manera sencilla las propiedades de los metales. La ductilidad y maleabilidad ocurre debido a que la deslocalización de electrones ocurre en todas las direcciones a manera de capas. Por tanto, ante un esfuerzo externo, estas capas se deslizan unas sobre otras, sin que se rompa la estructura. Por otro lado, dado que los electrones son móviles, permiten el flujo de corriente eléctrica, explicándose la conductividad eléctrica. Asimismo, ese movimiento de electrones puede conducir calor, transportando energía cinética de una parte a otra del metal.
 |
Observaciones
|
 |
Ejercicio 3.10 Explica el hecho de que un trozo de sodio metálico (11Na) puede cortarse con un cuchillo, mientras que es imposible hacer lo mismo con un trozo de hierro (26Fe). |
Teoría de bandas
La teoría de bandas se basa en el hecho de que los átomos que conforman un metal contiene orbitales atómicos, los cuales pueden estar llenos o vacíos. Si tenemos una gran cantidad de átomos muy juntos entre ellos, la superposición de orbitales da lugar a regiones, las cuales se denominan bandas.
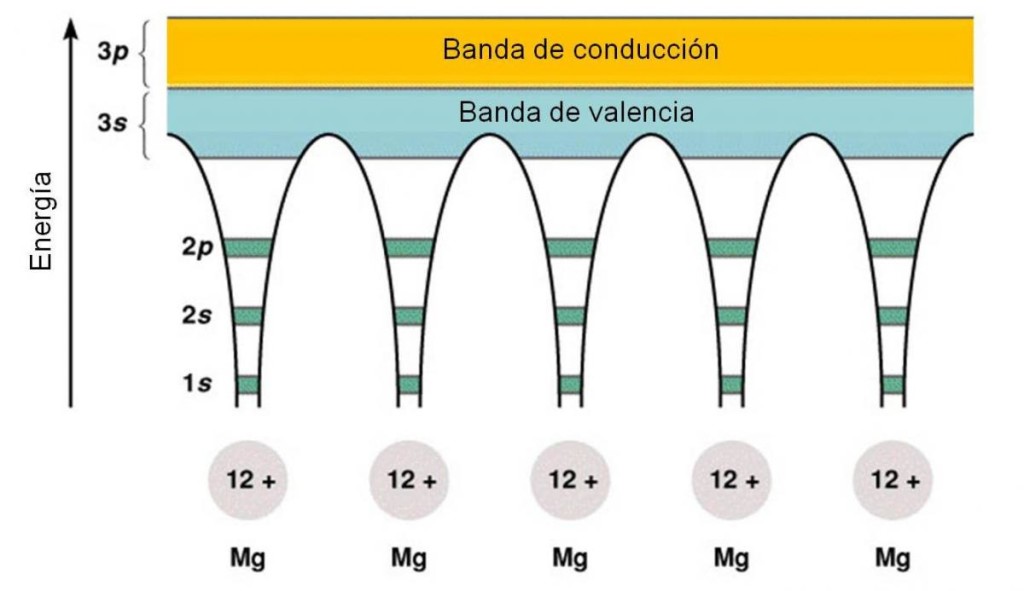
Analicemos el caso de magnesio, un metal con número atómico 12. Su configuración electrónica es [Ne]3s2, esto quiere decir que cada átomo tiene dos electrones de valencia ubicados en el orbital 3s, quedando los orbitales del subnivel 3p vacíos. Por tanto, al considerar el metal como muchos átomos de magnesio juntos, podemos imaginar la aparición de bandas, que no son más que muchos orbitales superpuestos. Una banda, correspondiente a la superposición de los orbitales 3s, estará llena de electrones y se llamará BANDA DE VALENCIA (porque contiene a los electrones de valencia). La banda formada por los orbitales del subnivel 3p está adyacente, pero vacía. Esta banda se denomina BANDA DE CONDUCCIÓN.
Figura 3.8. Diagrama de bandas para el magnesio.
En todo metal, las bandas de valencia y de conducción están muy próximas entre sí, y la energía necesaria para que un electrón pase de la banda de valencia a la de conducción es despreciable. Para que un metal conduzca la corriente, debe ocurrir el salto de electrones de la banda de valencia a la banda de conducción.
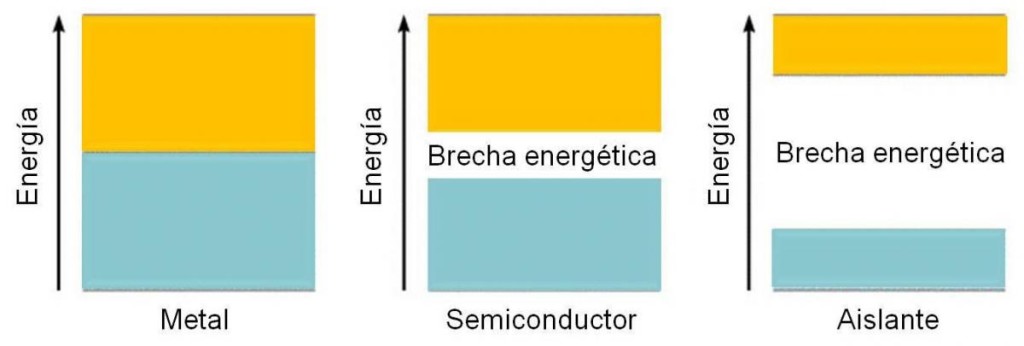
Sin embargo, hay algunos elementos de la tabla que se comportan como semiconductores. Estas especies son conductoras de la corriente y el calor sólo bajo ciertas condiciones. Ejemplo de semiconductores son el silicio (Si) y el germanio (Ge). Y, además, otros elementos de la tabla se comportan como aislantes, es decir, no conducen nunca la corriente eléctrica. Un ejemplo es el azufre (S). ¿Por qué ocurre esto?
En estos casos, es de esperar que la separación entre las bandas de valencia y de conducción sea mayor. En el caso de los semiconductores, la separación (Gap en inglés) es apreciable, pero es posible que un electrón pase a la banda de conducción al aplicarle cierta energía. En el caso de los aislantes, este salto no es posible, dada la gran diferencia energética que hay entre ambas bandas.
Figura 3.9. diferencia energética entre las bandas de valencia y de conducción en un metal, semiconductor y aislante.
Dopaje
Los semiconductores han ganado una gran importancia en los últimos tiempos, más aún con el desarrollo de la energía solar. Los paneles solares están basados en silicio, un material semiconductor. Pero ¿por qué se usa silicio, si sabemos que es un material que conduce poco la corriente?
Debemos recordar que un semiconductor conduce la corriente por aplicación de energía, que bien puede ser la energía que recibimos del sol. Pero también, podemos mejorar la conductividad del semiconductor por un proceso denominado dopaje. El dopaje consiste en introducir impurezas dentro del semiconductor para modificar su comportamiento. Las impurezas en mención son pequeñas cantidades de otros elementos químicos. Estas cantidades son tan pequeñas, que puede existir un átomo de la impureza por cada cien millones de átomos del semiconductor.
Analicemos al silicio, elemento del grupo 4 de la tabla. ¿Qué pasaría si reemplazamos un átomo de silicio por un átomo de fósforo? Dado que el fósforo es un elemento del siguiente grupo, tiene un electrón de valencia extra. Esto quiere decir que en la red metálica del silicio tendremos un electrón extra, que puede moverse por toda la red y, por tanto, conducir la corriente eléctrica. El proceso de añadir al silicio un elemento con un electrón de valencia extra se denomina DOPAJE NEGATIVO, ya que existe un exceso de electrones dentro de la red metálica.
Figura 3.10. Silicio dopado con fósforo.
Tomado de: “Esacademic” (http://www.esacademic.com/dic.nsf/eswiki/388497)
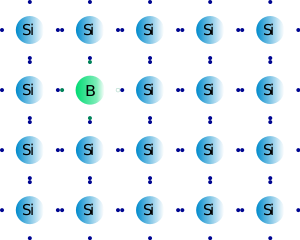
Por otro lado, la inserción de un átomo del grupo 3 dentro de la red del silicio producirá un “hueco” dentro de la estructura, justo donde estaba el electrón del átomo de silicio extraído. Este “hueco” mejorará también la conductividad, ya que los electrones adyacentes pueden desplazarse hacia el hueco, originándose movimiento de electrones, lo cual es imprescindible para la conductividad. El proceso de añadir al silicio un elemento con un electrón de valencia menos se denomina DOPAJE POSITIVO, ya que en este caso hay un déficit de electrones con respecto al semiconductor de partida. Un ejemplo lo constituye el dopaje de silicio con boro.
Figura 3.11. Silicio dopado con boro.
Tomado de: “Esacademic” (http://www.esacademic.com/dic.nsf/eswiki/388497)
 |
Observación El dopaje, ya sea positivo o negativo, mejora la conductividad eléctrica del semiconductor. La elección del tipo de dopaje dependerá del uso final que se le dé al dispositivo. |