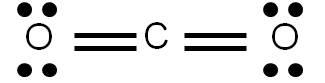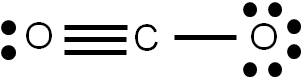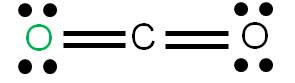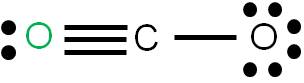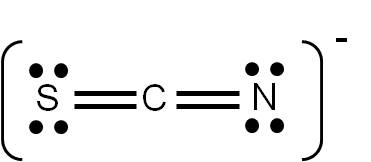3.4.2. Carga formal
Al representar una estructura de Lewis estamos describiendo la forma en que los electrones se distribuyen en una molécula dada. Sin embargo, en algunos casos es posible construir varias estructuras de Lewis para una misma especie, las cuales cumplen todos los requisitos aprendidos previamente. Veamos como ejemplo el CO2. Al calcular el número de enlaces que presenta esta molécula, obtendremos 4. Por tanto, podemos representar su estructura de Lewis de la siguiente forma:
Hemos hecho lo más lógico: si hay que unir dos átomos por medio de cuatro enlaces, pues cada átomo se une al central por medio de un doble enlace. Sin embargo, la siguiente estructura también cumple con los requisitos vistos anteriormente:
Vemos que hay cuatro enlaces covalentes, y cada átomo tiene el octeto completo. ¿Cuál de las dos estructuras es más razonable?
El concepto de carga formal nos ayudará a decidir cuál estructura es más correcta (nótese el término “más”: ambas estructuras son correctas, pero una de ellas es más estable que la otra). La carga formal nos representa la carga eléctrica que posee un átomo en una determinada molécula.
La carga formal de un determinado átomo se calcula de la siguiente forma:
CARGA FORMAL = [N° electrones de valencia] – [N° electrones no enlazados] – [N° de enlaces que tiene el átomo]
Es importante notar que debemos calcular la carga formal de TODOS los átomos que conforman una molécula (o ión) y que la suma de cargas formales debe ser igual a la carga eléctrica de la especie en estudio (si es una molécula neutra, debe ser cero; si es un ión, debe coincidir con la carga de éste).
La ESTRUCTURA MÁS ESTABLE será aquella que:
1. Tenga a sus átomos con cargas formales igual a cero.
2. Tenga a sus átomos con cargas formales similares y más cercanas a cero.
3. Tenga a los átomos más electronegativos soportando las cargas negativas.
 |
Ejemplo 3.6. Apliquemos el criterio de carga formal para la molécula de CO2. |
En este caso tenemos que unir dos átomos al átomo central utilizando cuatro enlaces. Podemos tener dos estructuras posibles: la estructura 1 y la estructura 2. Para cada estructura, calculamos las cargas formales de cada átomo:
Estructura 1
Estructura 2
Vemos que en ambos casos, la suma de cargas formales coincide con la carga del compuesto: cero (se trata de una molécula neutra). Según los criterios para determinar cuál es más estable, observamos que la estructura más estable es la 1, porque tiene a todos sus átomos con carga formal cero.
 |
Ejercicio 3.6 El ion tiocianato (SCN–) presenta tres estructuras de Lewis posibles. Utiliza el criterio de cargas formales para verificar que la siguiente es su estructura de Lewis más probable: |