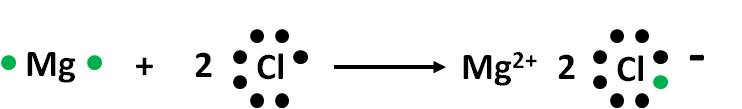3.3. Enlace iónico
El enlace iónico está presente en todos los compuestos iónicos, es decir, aquellos formados por la unión de un catión y un anión.
Recuerda que:
- Forman cationes aquellos elementos con baja energía de ionización (izquierda de la tabla), principalmente los metales de los grupos 1 y 2 de la tabla periódica.
- Por otro lado, los elementos con alta energía de ionización (no metales de la derecha de la tabla periódica) tienden a ganar electrones y, por tanto, forman con facilidad aniones, al ganar un electrón.
En consecuencia, el enlace iónico se forma cuando un metal cede electrones a un no metal. El metal se vuelve catión, alcanzando la configuración de gas noble, y el no metal, aceptando electrones, completa su octeto, adquiriendo también una configuración más estable. La atracción entre catión y anión es una fuerza electrostática, denominada enlace iónico.
Formación de un compuesto iónico
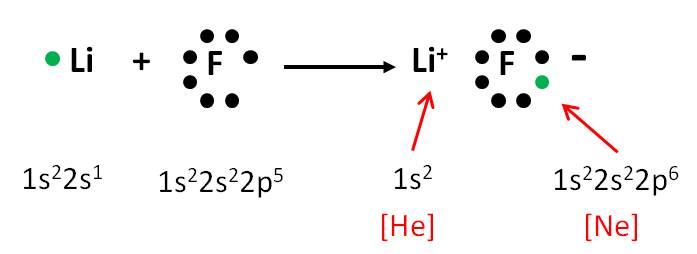
El fluroruro de litio (LiF) es un compuesto iónico. Al estar compuesto por litio y flúor, estos elementos se han tenido que combinar para formarlo. Analicemos cada elemento por separado:
Li, elemento del grupo 1, tiene un electrón de valencia y tendencia a formar cationes (perdiendo un electrón). Si el litio pierde un electrón, adquiere la configuración electrónica del helio (gas noble), formando el catión Li+.
F, elemento del grupo 7, tiene siete electrones de valencia y tendencia a formar aniones (ganando un electrón). Si el flúor gana un electrón, adquiere la configuración electrónica del neón (gas noble), formando el anión F–.
Por tanto, si entre ellos se combinan y el litio transfiere su electrón de valencia al flúor, ambos ganan una gran estabilidad. Se estará formando el compuesto iónico LiF, según la siguiente ecuación:
Observa la configuración electrónica de cada elemento después de la transferencia de electrones (lado derecho de la ecuación). Ambos elementos han alcanzado la configuración del gas noble más cercano.
Aplicando el principio de electroneutralidad, podemos deducir cuál será el compuesto iónico que se formará entre el magnesio y el cloro:
Mg, elemento del grupo 2, tiene dos electrones de valencia. Para alcanzar la configuración de gas noble debe perder dos electrones, formando iones Mg2+.
Cl, elemento del grupo 7, tiene siete electrones de valencia. Para alcanzar la configuración de gas noble tiene que ganar un electrón., y forma el anión Cl–.
Usando el principio de electroneutralidad, necesitamos dos aniones cloro (Cl–) por cada catión magnesio (Mg2+) para obtener un compuesto estable. Entonces, la ecuación de formación del cloruro de magnesio será:
 |
Ejercicio 3.2 Utiliza la simbología de Lewis para explicar la formación del compuesto iónico óxido de sodio (Na2O). |
Propiedades de los compuestos iónicos
- Son sólidos a temperatura ambiente.
- Se disuelven en agua.
- En estado sólido no conducen la electricidad.
- Conducen la electricidad si se encuentran en estado líquido o si han sido disueltos en agua.
- Tienen alto punto de fusión (temperatura de cambio de sólido a líquido), debido a la alta energía reticular que poseen.
Energía reticular (E)
Los compuestos iónicos se mantienen unidos debido a la fuerza electrostática existente entre los cationes y aniones. Esta fuerza es una magnitud medible y se conoce como “energía reticular”. Cuanto mayor sea esta energía, más difícil será separar a los iones que forman un compuesto iónico. Por tanto, a mayor energía reticular, mayor será el punto de fusión de un compuesto iónico.
La expresión de la energía reticular es la siguiente:
donde: Q1 = carga del catión (+1, +2, +3, etc); Q2 = carga del anión (-1, -2, -3, etc); d = distancia entre los iones
En otras palabras: la energía reticular es directamente proporcional al producto de cargas de los iones, pero inversamente proporcional a la distancia que existe entre ellos.
Nosotros no calcularemos valores de energía reticular, pero sí podemos utilizar la ecuación para comparar el punto de fusión de dos compuestos iónicos dados. Debemos tener presente que:
A mayor E (en valor absoluto), mayor punto de fusión
 |
Ejemplo 3.1. Predecir cuál compuesto tiene mayor punto de fusión, cloruro de sodio (NaCl) o cloruro de magnesio (MgCl2). |
Analicemos las cargas de los iones en cada caso:
NaCl: iones Na+ y Cl– ? Q1=+1 y Q2=-1 MgCl2: iones Mg2+ y Cl– ? Q1=+2 y Q2=-1
Dado que sodio y magnesio son elementos adyacentes en la tabla, el tamaño de éstos no cambia significativamente. Por tanto, vemos que la energía reticular (en valor absoluto) del MgCl2 es casi el doble de la del NaCl. Por tanto, el MgCl2 debe tener mayor punto de fusión. Esto lo confirmamos con los valores experimentales: el NaCl funde a 804°C, mientras que el MgCl2 lo hace a 1248°C.
 |
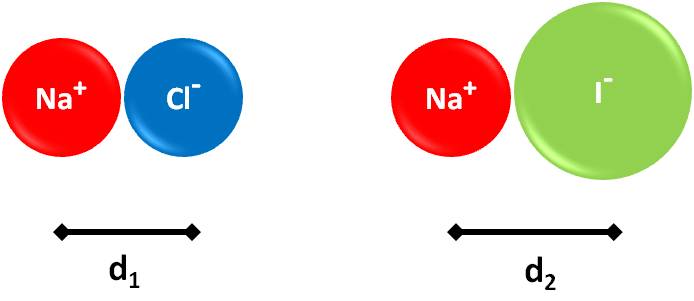
Ejemplo 3.2. Predecir cuál compuesto tiene mayor punto de fusión: cloruro de sodio (NaCl) o yoduro de sodio (NaI). |
Analicemos las cargas de los iones:
NaCl: iones Na+ y Cl– ? Q1=+1 y Q2=-1 NaI: iones Na+ y I– ? Q1=+1 y Q2=-1
En ambos casos, el numerador es el mismo (igual producto de cargas). Por tanto, debemos analizar las distancias existentes entre los iones en cada compuesto. Comparten un elemento común, el sodio. Sin embargo, el anión es diferente en cada caso. El yodo es más grande que el cloro (está más abajo en la tabla, dentro del mismo grupo). Por tanto, el anión yodo será más grande que el anión cloro. Al representarlos, tendremos lo siguiente:
De la imagen, podemos ver que la distancia entre los núcleos de los átomos de sodio y yodo en el NaI (d2) es mayor que la distancia existente entre los átomos de sodio y cloro en el NaCl (d1), debido a que el yodo es un elemento más grande. Por tanto, la energía reticular del cloruro de sodio será mayor (denominador más pequeño en la fórmula) y tendrá, entonces, un punto de fusión mayor. Podemos confirmarlo al analizar los valores experimentales: el NaCl funde a 804°C, mientras que el NaI lo hace a 660°C.