3.2. Simbología de puntos de Lewis
Gilbert Lewis (químico estadounidense, 1875-1946) propuso que los átomos se combinan para formar moléculas siempre que ello conlleve alcanzar una configuración electrónica más estable. Esta configuración estable se alcanza, en muchos casos, cuando el átomo alcanza la configuración de gas noble o, dicho en otras palabras, cuando se rodea de 8 electrones en su nivel más externo.
Figura 3.2. Gilbert Lewis (1875-1946).
Tomado de: “Fisicanet” (http://www.fisicanet.com.ar/biografias/cientificos/l/lewis.php).
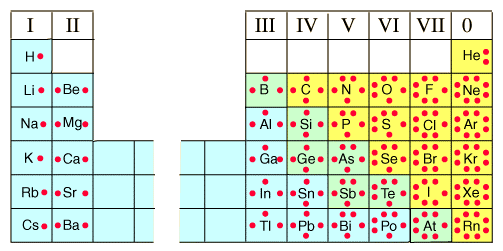
Los electrones que participan en la formación de enlaces (los del nivel energético más externo) se denominan electrones de valencia. Lewis desarrolló una simbología para denotar los electrones de valencia de cada átomo de la tabla periódica. Para ello, se coloca el símbolo de cada elemento y se rodea de puntos que representan a los electrones de valencia. En esta representación deben cumplirse reglas que ya hemos estudiado, como la regla de Hund.
Figura 3.3. Símbolos de puntos de Lewis para elementos de los bloques “s” y “p”.
Tomado de “HyperPhysics: Lewis dot diagrams of selected elements” (http://hyperphysics.phy-astr.gsu.edu/%E2%80%8Chbase/pertab/perlewis.html).