2.3.1. Principio de exclusión de Pauli – Principio de Aufbau – Regla de Hund
Unidad 2: Estructura electrónica de los átomos y la tabla periódica de los elementos
Principio de exclusión de Pauli
“Dos electrones en un átomo no pueden tener los cuatro números cuánticos iguales”
Si dos electrones tienen iguales n, l y m por tanto se encuentran en el mismo orbital, por lo tanto es necesario que un electrón tenga un s =+1/2 y el otro un s = -1/2
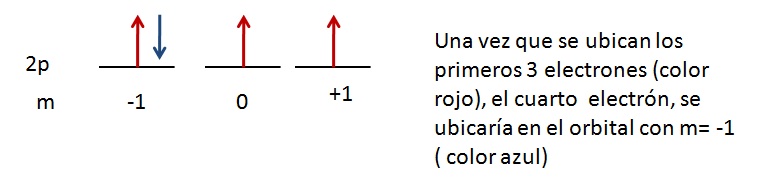
Analicemos el siguiente ejemplo:
Principio de llenado progresivo Aufbau (en alemán)
“Los electrones pasan a ocupar los orbitales de menor energía, y progresivamente se van llenando los orbitales de mayor energía“.
Según el principio de Aufbau, la configuración electrónica de un átomo se expresa mediante la secuencia siguiente:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d….sigue
La regla del serrucho nos ayuda a llenar adecuadamente esta serie.
(Tomado de: http://todosobresechura-quimica.blogspot.com/)
Regla de Hund
Los orbitales con igual nivel de energía (se refiere a orbitales con el mismo número cuántico n y el mismo número cuántico l), se llenan progresivamente de manera que siempre exista un mayor número de electrones desapareados.
Para comprender esto analicemos a los orbitales 2p, se tienen que llenar con 4 electrones, entonces: