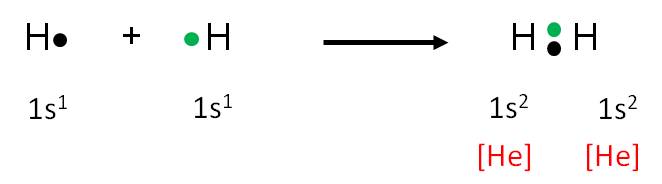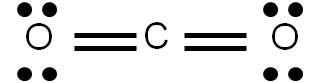3.4. Enlace covalente
La mayoría de sustancias químicas no posee las características de los compuestos iónicos (no conducen la corriente en estado líquido o poseen alto punto de fusión). Ejemplos son la gasolina o el agua: ambas sustancias son líquidas a temperatura ambiente. Estas propiedades diferentes deben explicarse según otro modelo de enlace, donde no existe una transferencia de electrones de una especie a otra.
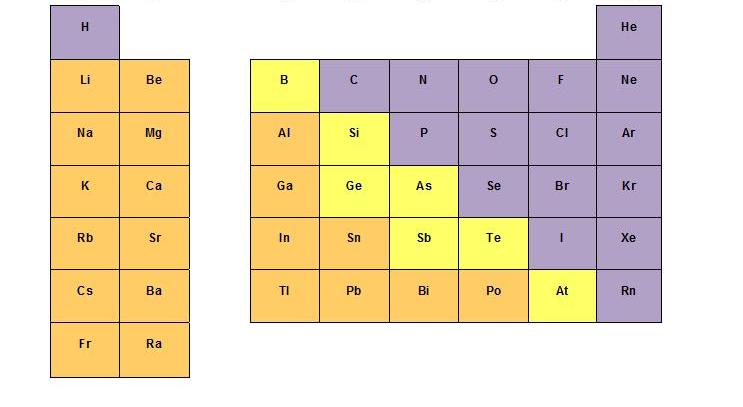
En el caso del enlace covalente, las especies que lo forman son no metales (exclusivamente). Cuando dos no metales se unen, comparten sus electrones, siempre intentando alcanzar la configuración del gas noble más cercano (8 electrones alrededor de cada átomo).
Figura 3.4. No metales (destacados en morado) que forman enlaces covalentes.
Tomado de “Universidad de California – Davis Chemwiki” (http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Descriptive_Chemistry/Main_Group_Elements/Case_Studies/Reactions_of_Main_Group_Elements_with_Hydrogen).
El H2 es un gas presente en el aire, en una concentración de 0,5%. Esta molécula está formada por dos átomos de hidrógeno (un no metal), por tanto, la unión entre tales átomos debe ser un enlace covalente. Utilicemos la simbología de Lewis para representar la formación de la molécula de H2:
Ningún átomo es más electronegativo que el otro. Por tanto, los electrones no se transfieren de una especia a otra, sino quese comparten. Observemos que cada uno de ellos ha alcanzado la configuración del gas noble más cercano, helio, que tiene 2 electrones de valencia.
Representemos ahora la formación de la molécula de HCl (ácido clorhídrico):
La compartición del par de electrones permite que cada átomo tenga configuración de gas noble: el hidrógeno tiene alrededor de él dos electrones (configuración electrónica del helio), mientras que el cloro está rodeado de ocho electrones (configuración electrónica del argón).
Enlaces múltiples, σ y π
La formación del enlace covalente no implica la compartición de un único par de electrones entre dos átomos. Es posible que ciertos átomos, como el carbono, nitrógeno, oxígeno y azufre, entre otros, puedan compartir dos y hasta tres pares de electrones con otro átomo. Estos enlaces se denominan enlaces múltiples.
Por ejemplo, en la molécula de nitrógeno (N2) cada átomo de nitrógeno se encuentra compartiendo tres pares de electrones, es decir, hay un enlace triple.
La molécula de dióxido de carbono (CO2) tiene al carbono como átomo central y comparte dos pares de electrones con cada uno de los átomos de oxígeno unidos a él: tiene un enlace doble con cada átomo de oxígeno.
Los enlaces múltiples se denominan enlaces π (pi), mientras que los enlaces simples se llaman σ (sigma). Como requisito, toda unión de átomos debe ser de al menos un enlace simple (si no, no existiría unión). Entonces, todo enlace simple es σ. La presencia de un enlace múltiple añade enlaces π a la unión.
En efecto, en la molécula de CO2 vemos que el carbono se une al oxígeno por un enlace doble: existe entonces un enlace σ(el básico) y un enlace π: dos enlaces en total. Por otro lado, en la molécula de N2 observamos una triple unión entre los átomos de nitrógeno. Existe por tanto un enlace σ y dos enlaces π.
Observa en ambas estructuras que, independientemente del número de enlaces σ o π que posean, cada átomo tiene el octeto completo.