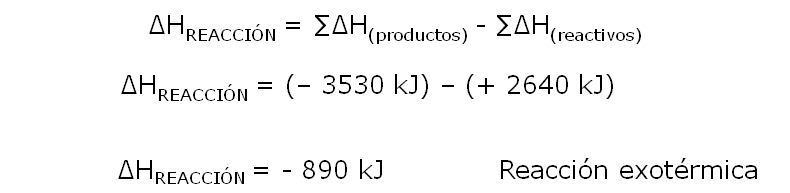1.4.2.- Cálculo del calor de reacción: Energías de Enlace
Entalpías de Enlace o energía de enlace
Una medida de la estabilidad de una molécula es el valor de su Energía de Enlace, cuanto más unidos estén los átomos en una molécula, mayor será el valor de la energía de enlace.
Se puede definir como energía de enlace, a la energía necesaria para romper un enlace específico de un mol de moléculas al estado gaseoso.
Cuando se forma un mol del mismo tipo de moléculas a partir de átomos gaseosos, la magnitud de la energía es igual, pero de signo contrario, esto es, se libera energía.
En una reacción química los reactantes reacciona entre sí y producen productos. Esto ocurre porque los enlaces de cada una de las sustancias que constituyen los reactantes, deben romperse para re-arreglarse y dar paso a la formación de nuevos enlaces, éstos nuevos enlaces formarán los productos de la reacción
Siempre que se quiera romper enlaces tendremos que suminstrar energía (valores positivos), mientras que siempre la formación de un nuevos enlaces liberará energía. 
 |
|
 |
|
¿Cómo calcular el Calor de Reacción, o Entalpía de Reacción , a partir de la energías de enlace?
En el ejemplo vamos a calcular de reacción, a traves de las Energía de Enalce para la reacción de combustión del metano. Esta combustión transcurre mediante la siguiente reacción:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Si escribimos las formulas estructurales de cada uno de los reactantes y productos, podremos estableceer que enlaces se ROMPEN y cuáles enlaces se FORMAN.
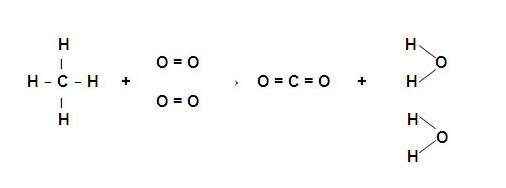 Se hacemos la contabilidad de enlaces rotos y formados tendremos los datos de la tabla siguiente:
Se hacemos la contabilidad de enlaces rotos y formados tendremos los datos de la tabla siguiente:
| Enlaces Rotos | Enlaces Formados |
| 4 enlaces C-H | 2 enlaces C=O |
| 2 enlaces O=O | 4 enlaces H-O |
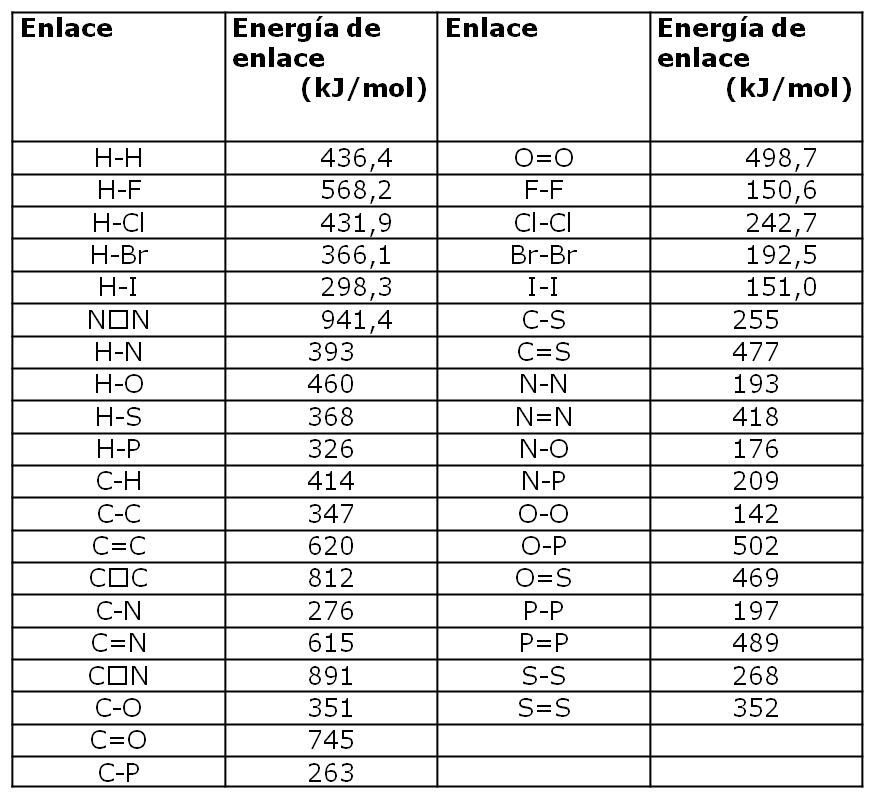
En tablas se puede encontrar el valor de las energía de enlace para los enlaces rotos y formados:
| Enlace | Energía de Enlace EE (kJ/mol) |
| C-H | 413 |
| O=O | 494 |
| C=O | 801 |
| H-O | 482 |
Ahora que tenemos el número de enlaces rotos y el número de enlaces formados, y en tablas hemos encontrado elvalor de la energía de enlace.
Debemos recordar que hay que suministrar energía para romper un enlace (valor positivo de la EE), y se libera energía al formar un enlace (valor negativo de la EE)
Podemos pasara a calcular la energía enlace total de enlaces rotos y la energía de enlace total de enlaces formados:
El número de enlaces rotos en un mol de moléculas x Energía de enlace:
- 4 enlaces C-H x 413 kJ = 1652 kJ
- 2 enlaces O=O x 494 kJ = 988 kJ
Romper los enlaces requiere de una energía de 2640 kJ
El número de enlaces formados en un mol de moléculas x energía de enlace:
- 2 enlaces C=O x (- 801 kJ) = (– 1602 kJ)
- 4 enlaces H-O x (- 482 kJ) = (– 1928 kJ)
Formar enlaces libera una energía de (- 3530 kJ)
Teniendo en cuenta que el calor de reacción, es la variación de energía de la posición final (productos), menos la variación de energía de la posición inicial (reactivos).
Podemos realizar el cálculo siguiente:
A continuación tienen una tabla con algunos valores de enregía de enlace (EE)