2.4. Tabla periódica de los elementos y propiedades periódicas
La tabla periódica de los elementos
En la introducción a la Unidad 2, ya veíamos cómo los científicos del siglo XIX tenían un vaga idea de los átomos y de las moléculas y no sabían de la existencia de los electrones ni protones. Ellos pudieron desarrollar la tabla periódica, teniendo en cuenta las relaciones entre las masas atómicas y las propiedades físicas y químicas de los elementos que conocían en esa época.
Hoy en día, después de los conocimientos adquiridos por la mecánica cuántica, la configuración electrónica de los elementos, el avance de la tecnología, se tiene la tabla periódica. En donde hasta la fecha, se tienen reportados 111 elementos.
 |
Aquí encontrarás una tabla períodica: |
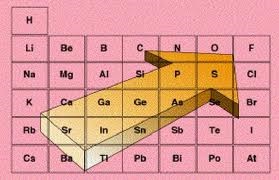
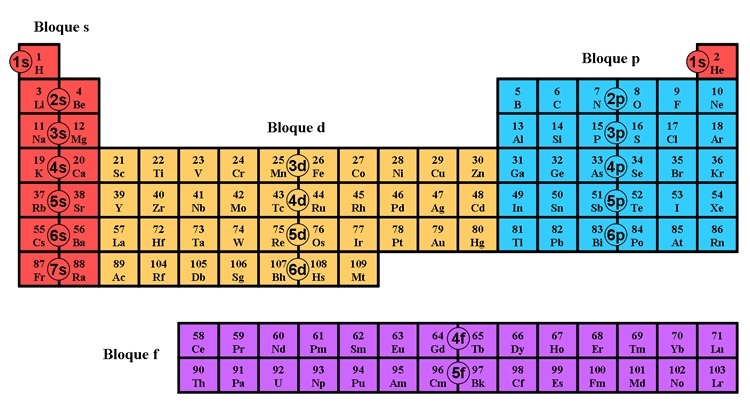
La TABLA PERIÓDICA que hoy conocemos está constituida por columnas y filas. Donde las filas se conocen comoPERIODOS y las columnas como GRUPOS. Los elementos están ordenados por el número atómico (Z), aumenta de izquierda a derecha y de arriba para abajo.
Pero esta agrupación no es al azar, si recordamos:
- Que el principio de Aufabau nos dice que los electrones de los elementos se van agregando progresivamente.
- Que el electrón diferenciador es el último electrón que se coloca en la configuración electrónica del elemento, que es el que marca la diferencia entre un elemento y el otro.
- Que el aumento de un electrón dentro de la configuración electrónica ( aumento de un protón), implica que varia el elemento, pues cambia el número atómico, que identifica al elemento.
 |
Teniendo en cuenta estos conceptos podemos comprender como es que está organizada la tabla periódica, para ello observa la siguiente figura: |
 |
|
Analizando la tabla periódica anterior:
Los elementos de la tabla periódica, de acuerdo a la posición que tengan en la tabla periódica, tendrán una tendencia a ganar o perder electrones para alcanzar la configuración electrónica de gas noble.
Esto luego nos permitiran entender varias de las propiedades periódicas de la tabla, tales como el tamaño atómico, energía de ionización y afinidad electrónica.
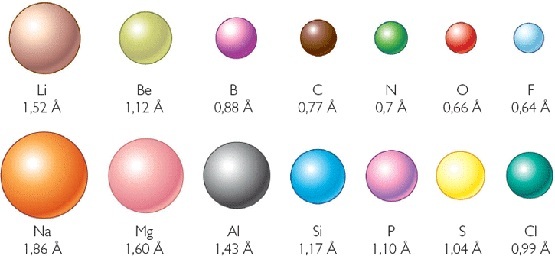
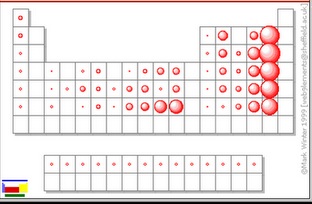
TAMAÑO ATÓMICO
Antes de poder estudiar el tamaño atómico, debemos:
- Establecer que el término tamaño atómico o radio atómico es un término referencial, se interpreta como el radio de una esfera dentro de la cual se encuentra la máxima probabilidad de hallar los electrones de un átomo.
- Comentar que las numerosas propiedades físicas incluidas la densidad, el punto de fusión, el punto de ebullición están relacionadas con el tamaño de los átomos, pero el tamaño es muy difícil de definir.
Además tenemos que tener en cuenta dos aspectos:
- Variación del tamaño en el GRUPO, para ello es necesario analizar la variación de la configuración electrónica de los elementos que se encuentran en el mismo grupo.
- Variación del tamaño en el PERIODO, para ello es necesario analizar la variación de la carga nuclear efectiva dentro del mismo periódo.
 |
Dentro de un grupo |
Si ubicamos a los elementos que se encuentran dentro de un mismo grupo, sabemos que:
|
|
 |
Actividad Interactiva 2.5 A Ingresa al siguiente enlace: http://www.educaplus.org/sp2002/properiodicas/radatomico.html Ingresa al link, ubica en el lado izquierdo “Radio Atómico”, y marca “tabla” en el lado derecho. En la tabla, con el cursor, ubica dentro de un grupo a los elementos y ve avanzando en el periodo, analiza los valores de radio atomico que se van mostrando. Relaciona estos valores con el hecho que a medida que se avanza en el período, va creciendo el número cuántico por ende la capa electronica. |
| Podemos concluir que, en un GRUPO, el tamaño se incrementa a medida que aumenta el PERÍODO. |
 |
Dentro de un periódo |
| Si ubicamos a los elementos dentro del mismo periódo, el número cuántico prinicpal (n) no variarará, pero se irá incrementando, de uno en uno, los valores del número cuantico azimutal (l). | |
 |
Actividad Interactiva 2.5 B Vuelve a ingresar al link anterior: http://www.educaplus.org/sp2002/properiodicas/radatomico.html Ubica en la tabla periodica del enlace anterior, en el periodo 3, analiza los valores de radio atómico para el 11Na, 13Al, 15P, 17Cl; anota los valores para que te sirvan de referencia. Calcula la carga nuclear efectiva para estos mismos elementos (revisa en esta misma unidad, el concepto de ello, si no te acuerdas). Ahora puedes relacionar el tamaño atómico con la variación del valor de la carga nuclear efectiva. ¿Cuál es tu conclusión? |
| Podemos concluir que, dentro de un PERÍODO, a medida que aumenta el valor del Zef , el tamaño atómico disminuye. |
Radio iónico o tamaño iónico
Los iones se forman cuando, un elemento, pierde o gana electrones. Si los pierde se le conoce como catión y si los gana se le conoce como anión. Cualquiera de las dos situaciones suceden porque el elemento al ganar o perder electrones , alcanza la configuración electronica de gas noble.
Si el elemento gana electrones:
El electrón o electrones ganados se colocan en los orbitales vacíos del elemento, transformando el átomo en un anión. Lacarga nuclear es constante, tanto en el átomo neutro como en el anión, pero aumenta la repulsión entre los electrones, pues estos han aumentado, esto produce un aumento del tamaño iónico.
Si el elemento pierde electrones:
Los electrones que se pierden, por lo genereal, son los electrones de valencia, es asi como el elemento se converte en un cartión. La carga nuclear sigue siendo la misma, tanto en el átomo neutro como en el catión, pero al disminuir el número de electrones, disminuye la repulsión entre ellos, lo que hace que se contraiga el átomo, disminuyendo su tamaño frente al atomo neutro.
|
Podemos concluir que:
|
ENERGÍA DE IONIZACIÓN
La energía de ionización o potencial de ionización, es la energía mínima (kJ/mol) que se requiere para retirar un electrón de un atomo al estado gaseoso. La magnitud de la energía de ionización es una medida de qué tan fuertemente está unido el electrón al átomo.
Tenemos que tener en cuenta que el electrón que se pierde serán el que se encuentre más alejado del núcleo.
La ecuación que representa la energía de ionización (EI) es:
X(g) + EI → X(g) + + 1 e–
Por convención, la energía que se debe proporcionar para retirar el electrón de un átomo gaseoso, será siempre POSITVA.A mayor valor de la Energía de Ionización EI, más dificil será extraer un electrón del átomo.
Teniendo en cuenta que la energía de ionización esta directamente relacionada con la facilidad que tiene un elemento para perder un electrón, podemos establecer que:
En un GRUPO
Conociendo que a medida que se incrementa el periódo, el tamaño atómico crece. Esto hace que el último electrón del átomo, se encuentre más alejado del núcleo, por lo tanto este electrón será más fácil de remover, que si se encontrará mas cercano al núcleo.
| Lo que nos lleva a la conclusión que a medida que aumenta el período en un grupo, el valor de la energía de ionización disminuye. |
En un PERÍODO
Conociendo que en un periódo, a medida que aumenta el Zef, disminuye el tamaño del átomo. Esto hace que el último electron se encuentre más cercano al núclo, lo que hará que sea más difícil retirarlo del átomo.
| Lo que nos lleva a la conclusión que, a medida que se avanza dentro de un mismo periódo, el valor de laEnergía de Ionización aumenta, en otras palabaras conforme disminuye el tamaño en un periodo, aumenta la Energía de Ionización. |
AFINIDAD ELECTRÓNICA
Otra propiedad de los átomos que influyen en sus propiedades químicas es la capacidad para aceptar uno o más electrones.Esta propiedad se denomina Afinidad Electrónica, la cual es la energía liberada cuando un elemento, al estado gaseoso, acepta un electrón y se convierte en un anión.
Al ser energía liberada, tendrán por convención, signo negativo. La ecuación de la afinidad electrónica (AE) está dada por:
X(g) + e– → X(g)– + AE
A medida que un elemento, al aceptar un electrón, se acerque a la configuración de gas noble, liberará más energía al aceptar un electrón. La razón es por que gana estabilidad electrónica.
|
Lo que nos lleva a la conclusión que a medida que avanzamos en un periodo, si libera mayor energía al aceptar un electrón. Lo que significa que el valor absoluto de la afinidad electrónica, aumentará. Esto tambien se puede expresar que a medida que disminuye el tamaño en un periodo el valor abasoluto de la afinidad electrónica aumenta. |