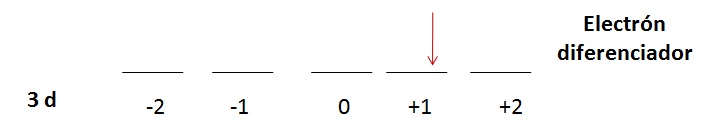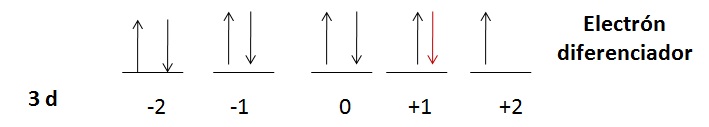2.3.3. Propiedades magnéticas – electrón diferenciador y de valencia
Todos conocemos que un imán atrae un trozo de hierro (un clavo), pero si colocamos un trozo de cobre, no será atraído con la misma fuerza por el imán. Si analizamos la configuración electrónica del átomo de hierro (Fe), y la comparamos con la configuración electrónica de un átomo de cobre (Cu), puedes compararlo en el siguiente enlace:http://concurso.cnice.mec.es/cnice2005/93_iniciacion_interactiva_materia/curso/materiales/atomo/celectron.htm
Veremos que el número de electrones desapareados en el Fe, es mayor que el número de electrones desapareados del Cu.
Luego podemos concluir que si un átomo presenta electrones desapareados, al menos uno, habrá un efecto magnético. A las sustancias con estas propiedades se les conoce como paramagnéticas. Sus átomos serán atraídos por un campo magnético, la fuerza de la atracción será mayor a mayor número de electrones desapareados presente. En nuestro ejemplo el Fe es mucho más paramagnético que el Cu.
En cambio si una sustancia no presenta electrones desapareados en su configuración electrónica, es decir todos sus electrones se encuentran apareados se dirá que esta sustancias es diamagnéticas, sus átomos serán repelidos frente a un campo magnético.
Electrón Diferenciador
Se denomina electrón diferenciador al último electrón que se coloca en la secuencia de la configuración electrónica. Este puede ser identificado por sus cuatro números cuánticos.
La información del electrón diferenciador nos proporciona el número atómico del elemento.
Electrones de Valencia
Son todos los electrones que se en encuentran en el nivel más alto de energía.
 |
Ejercicio 2.6
|