2.3. Configuración electrónica de los átomos y números cuánticos
Unidad 2: Estructura electrónica de los átomos y la tabla periódica de los elementos
Sin duda alguna, Bohr contribuyó de manera significativa a la comprensión de los átomos y su teoría de que la energía de un electrón en un átomo está cuantizada sigue prevaleciendo en el siglo XXI. Pero su teoría no describía el comportamiento de los electrones en un átomo polielectrónico.
Fue en 1926 que Erwin Schrödinger, físico austriaco, desarrolló una ecuación que permite describir el comportamiento y la energía de las partículas subatómicas. A esta ecuación Schrödinger la llamo función de onda ψ (psi).
Antes de continuar debemos aclarar algunos conceptos:
Orbital atómico
Un orbital atómico es la máxima probabilidad de encontrar a un electrón.
Para entenderlo mejor utilizaremos la siguiente analogía.
Si un alumno sale todos los días de su casa a la misma hora, camina por la misma ruta hasta llegar a la universidad, una vea ahí siempre usa el mismo camino para llegar a su aula, en ella permanece 4 horas, de ahí sale y va por el mismo camino a la cafetería. Si esto lo repite todos los días desde las 7:00 a.m. que sale de clase hasta la 1:00 p.m. que sale de la cafetería. Podríamos saber dependiendo de la hora donde podríamos ubicarlo. La probabilidad de encontrarlo en ese recorrido es muy alta.
Si pensamos ahora que la ruta seguida por el alumno es el orbital y que el alumno es el electrón. La probabilidad de encontrar al electrón es muy alta dentro del orbital.
Configuración electrónica
Expresa la secuencia de los electrones contenidos en un átomo, estos electrones se encuentran en los orbitales. Las características de estos orbitales (nivel, forma y orientación), está definida por los números cuánticos.
Los números cuánticos
Los números cuánticos son los parámetros de la función de onda, ellos definen las características de los orbitales, a continuación los veremos en detalle:
NÚMEROS CUÁNTICOS
Los números cuánticos son los parámetros de la función de onda, ellos definen las características de los orbitales. Estos son:
El número cuántico principal (n)
- Nos informa sobre el tamaño y el nivel de energía del orbital.
- Los valores que puede tomar el número cuántico principal n, son números enteros que van desde
- n= 1, 2,….
- A mayor número cuántico más grande será el orbital y tendrá una mayor energía. Implica que estará más alejado del núcleo de un átomo.
El número cuántico azimutal o del momento angular (l)
- Nos informa sobre la forma que adopta el orbital.
- Depende del número cuántico n.
- Los valores que puede tomar el número cuántico azimutal (l), son números enteros que van desde l = 0, 1, 2,… n-1.
- Se les signan letras referentes a la forma que adoptan:
| Valores de l | Nombre del orbital | Forma característica del orbital |
| l = 0 | Orbital “s” | esférica |
| l =1 | Orbital “p” | Bi-lobular |
| l =2 | Orbital “d” | Tetra-lobular |
| l =3 | Orbital “f” | Octa-lobular |
El número cuántico magnético (m)
- Nos informa sobre la orientación espacial del orbital.
- Depende del número cuántico (l).
- Los valores que puede tomar el número cuántico magnético (m), son número enteros que van desde m = – l, ….0….+ l.
 |
Actividad Interactiva 2.3 Ingresen al link http://winter.group.shef.ac.uk/orbitron/AOs/4s/index.html Y observen el tamaño, forma y orientación de cada uno de los orbitales. |
Número de electrones que alberga un orbital
Cada orbital puede albergar hasta dos electrones.
Analicemos que información nos porporciona el orbital 2s
Con esta información sabremos que el orbital se encuentra en el nivel 2 (número cuántico n=2), que tiene forma esférica (orbital s, significa que tiene un l=0), y que su número cuántico magnético, m=0; es decir no importa como se coloque tendrá la misma información. Si pensamos en la esfera esto es cierto.
Sabemos además que cada orbital puede albergar hasta dos electrones, ¿cómo podemos diferenciar a estos electrones? Para ello se emplea un cuarto número cuántico, el del espín electrónico “s“, también se le da la notación ms.
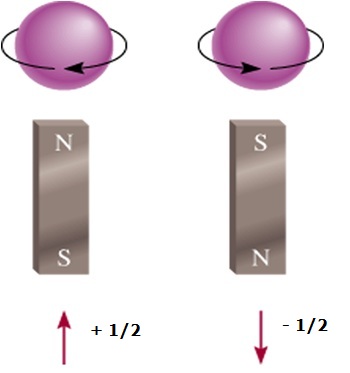
El número cuántico del espín electrónico (s)
- Es propio del electrón, no depende del orbital
- Puede tomar solo dos valores + ½ ó – ½
- Los signos opuestos indican el giros opuestos, uno gira en un sentido horario, y el otro en sentido antihorario.
- El valor de s + ½ se representa con una flecha hacia arriba
- El valor de s – ½ se representa con una flecha hacia abajo
 |
Si tenemos que analizar la capa electrónica correspondiente al nivel n=2 |
1. Hacemos el análisis de los números cuánticos relacionados con el valor de n=2. Esta información nos proporcionará el número de orbitales de la capa electrónica.
2. Cada orbital puede albergar 2 electrones de spin diferente, lo que nos permitirá conocer el número total de electrones de la capa.
| n = | 2 | |
| l = | 0, 1 | |
| m = | -1, 0, +1 | |
Luego de realizar los cálculos de la tabla anterior llegamos a la conclusión que se tienen 4 orbitales que pueden albergar hasta 8 electrones.