2.2. Ondas Electromagnéticas – Teorías de Planck y Bohr
Unidad 2: Estructura electrónica de los átomos y tabla periódica de los elementos
Para poder comprender la teoría cuántica de Plank, debemos revisar algunos conceptos sobre ondas. Una onda es una perturbación que se propaga desde el punto en que se produjo hacia el medio que rodea ese punto.
Todas las ondas, menos las ondas electromagnéticas, requieren de un medio físico para propagarse. Éste medio físico se deforma y se recupera vibrando al paso de la onda.
Una onda transporta energía y cantidad de movimiento, pero no transporta materia. Esto quiere decir que las partículas vibran alrededor de la posición de equilibrio pero no viajan con la perturbación.
En función del medio físico que requieren las ondas para su propagación, éstas se clasifican en mecánicas y electromagnéticas. Las ondas mecánicas requieren un medio físico para propagarse. Las electromagnéticas no requieren de un medio físico, se pueden propagar en el vacío.
Propiedades de las ondas
Las ondas se caracterizan por su longitud de onda, frecuencia y amplitud.
- La longitud de onda (λ, lambda), es la distancia entre dos crestas sucesivas de la onda, se mide en unidades de longitud.
- La frecuencia (ʋ, nu) es el número de ondas que pasan por un punto en un segundo, sus unidades son segundo-1.
- La amplitud es la distancia vertical de la línea media a la cresta de la onda o al valle.
Radiación Electromagnética
Se denomina radiación electromagnética a la emisión y transmisión de energía en forma de ondas electromagnéticas. Las ondas electromagnéticas viajan en el vació a la velocidad de la luz (3,0 x 108 m/s).
Gracias a las investigaciones realizadas y a los avances hechos en este campo, podemos hoy en día saber cuál es la naturaleza de la luz: la luz es una perturbación de carácter electromagnético, que se transmite en el vacío.
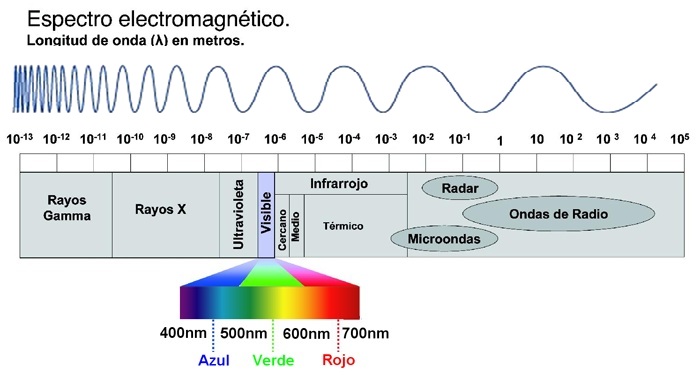
En la siguiente figura pueden observar los diferentes tipos de radiación electromagnética, cada una de ellas tiene diferentes valores de longitud de onda y por ende, de frecuencia de radiación.
(Tomado de: https://www.vilab.cl/p/espectro-electromagnetico)
El espectro electromagnético se extiende desde la radiación de menor longitud de onda, como los rayos gamma y los rayos X, pasando por la luz ultravioleta, la luz visible y los rayos infrarrojos, hasta las ondas electromagnéticas de mayor longitud de onda, como son las ondas de radio.
 |
Observación Las ondas de menor longitud de onda son las de más alta frecuencia. Cuanto mayor sea la frecuencia mayor será la energía de la onda, esto lo veremos más adelante. |
Teoría Cuántica de Planck
Si nos imaginamos un trozo de hierro, Fe, que se coloca al fuego durante un tiempo, al retirarlo podemos sentir el calor que está emitiendo y percibir una coloración rojiza.
Si has tenido la oportunidad de observar el interior de un foco de luz incandescente (que ya no se usn) de una lámpara, viste un alambre de tungsteno (W); si se “prende” la lámpara, la corriente llega al alambre de tungsteno, le proporciona energía y de inmediato se vuelve incandescente y emite una luz blanca brillante. El alambre que es tungsteno, emite una radiación que cae dentro del espectro electromagnético.
Los sólidos, al calentarse, emiten radiación electromagnética, esta radiación puede abarcar una gran gama de longitudes de onda. Si estas longitudes de onda caen dentro del espectro visible las podremos ver. Observen en la figura del espectro electromagnético, el rango de longitud de onda del VISIBLE.
Ahora bien, hacia finales del siglo XIX, estas mismas demostraciones llevaron a los científicos a establecer que la cantidad de energía radiante emitida por un objeto a cierta temperatura dependía de la longitud de onda, pero no podían ellos en esa época y con los conceptos que tenían, explicar la razón.
El físico alemán Max Planck, resolvió el problema en 1900, con una suposición que se apartaba de las teorías que por aquella época manejaban los científicos.
Él postuló que la materia (átomos y moléculas) podían emitir o absorber energía en pequeñas unidades discretas (como pequeños paquetes). Planck les dio el nombre de cuanto de energía y lo definió como la mínima cantidad de energía que podía ser emitida o absorbida en forma de radiación electromagnética.
La energía (E) de un solo cuanto de luz estaba dada por:
E= h ʋ
Donde:
• h, es la constante de Planck, cuyo valor es 6,63×10-34 J.s/fotón
• ʋ, es la frecuencia de la radiación.
 |
Ejercicio 2.3 Observa la figura que se da a continuación: |
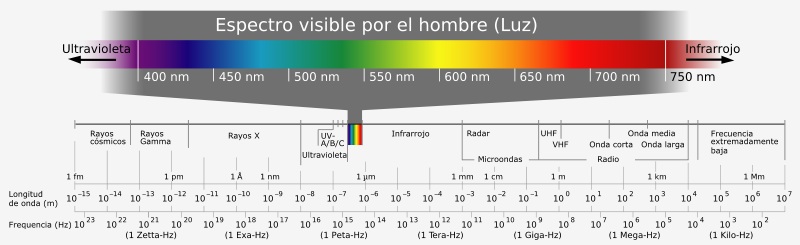
(Tomado de: http://commons.wikimedia.org/wiki/File:Electromagnetic_spectrum-es.svg Author: Horst Frank) |
|
| 1. Luego de analizar la figura del espectro y teniendo en cuenta la ecuación de Planck, llega a una conclusión sobre si la energía involucrada en los rayos gamma, será mayor, menor o igual a la energía involucrada en la región del infrarrojo; y da una explicación. NO realices cálculos, solo analiza la figura y ten en cuenta la ecuación de Planck.
2. Si en la figura te fijas en la radiación cuya longitud de onda tiene un valor de 600 nm, podemos observar que cae en el visible.
3. Si se tiene una energía de 6,63 x 10-19 J , determina la frecuencia y la longitud de onda de esta radiación y estima en qué región del espectro cae. |
|
Contribución de Bohr a la teoría atómica moderna
Si nos situamos en el año 1913, poco después de los descubrimientos de Planck y de Einstein (cabe señalar que Einstein denominó fotón, a lo que Planck llamó cuanto), los científicos consideraban a los átomos, como unidades donde los electrones giraban a grandes velocidades alrededor del núcleo, en orbitas circulares. Este modelo resultaba atractivo, pues se asemejaba al modelo solar.
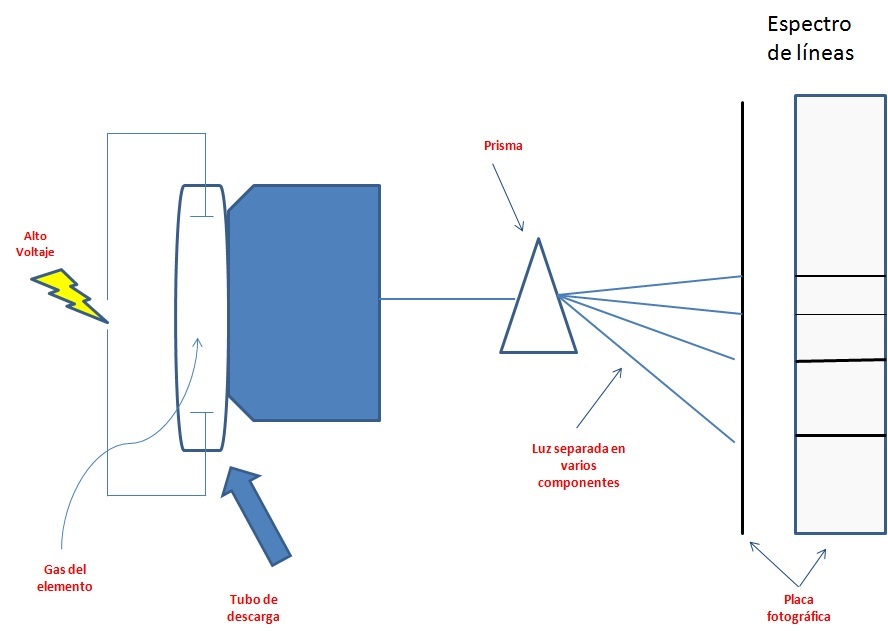
Pero los científicos de la época, con estas consideraciones no lograban explicar la razón por la cual los espectros de emisión de los átomos al estado gaseoso, no mostraban una distribución continua de longitudes de onda del rojo al violeta; en lugar de ello, los átomos producían líneas brillantes en diferentes partes del espectro visible. Estos espectros de líneas corresponden a las emisiones de luz solo a longitudes de onda específicas.
 |
Actividad interactiva 2.2 Ingresa al enlace: http://herramientas.educa.madrid.org/tabla/espectros/spespectro.html Elige un elemento de la tabla periódica que ahí se muestra y observa el espectro de emisión. Repite con varios elementos para que observes la diferencia que existen entre ellos. Luego analiza el espectro de emisión del hidrógeno y observa cuántas líneas tiene el espectro del átomo de hidrógeno. |
Postulado de Niels Bohr
Cuando el electrón del átomo de hidrógeno se encuentra en el nivel 1, se dice que se encuentra en el estado basal o fundamental; el nivel basal (n=1) es el nivel de mínima energía, el átomo se encuentra estable.
Cuando el electrón del átomo de hidrógeno absorbe energía, puede subir a niveles más altos de energía, pero solo a valores establecidos (n= 1,2, 3,..)
Si hacemos la siguiente analogía:
Si la esfera fuera una pelota y se le diera una patada (energía) para que suba la escalera, ésta nunca se podría quedar suspendida entre dos escalones. Si el impulso no es tan fuerte, no alcanza el escalón deseado y cae al escalón más bajo.
Ahora bien:
La pelota sería el electrón, la patada sería la energía proporcionada. Ésta energía es la que el electrón absorbe y puede llegar a ciertos escalones, que son los niveles energéticos.
Relación entre la energía involucrada en un salto energético con la frecuencia o longitud de onda
Si podemos calcular la energía absorbida por un electrón (cuando sube de nivel energético) o la energía emitida, cuando éste baja de nivel energético, podemos también relacionar la variación de energía con la longitud de onda o con la frecuencia involucrada en esa energía.



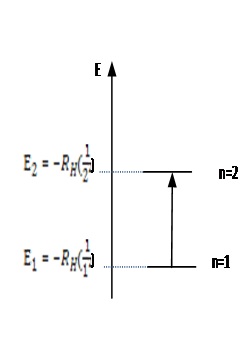 1. Calcula la energía absorbida en el salto energético del nivel 1 al nivel 2. Señala el signo de la energía ABSORBIDA.2. Repite el cálculo, pero ahora considera que el electrón se encuentra en el nivel 2 y cae energéticamente al nivel basal. Señala el signo de la energía EMITIDA.3. Determina la energía del nivel n = 3. Analiza y concluye si los espaciados entre niveles tienen el mismo valor, si aumentan o si se van haciendo cada vez más pequeños. Justifica tu respuesta.
1. Calcula la energía absorbida en el salto energético del nivel 1 al nivel 2. Señala el signo de la energía ABSORBIDA.2. Repite el cálculo, pero ahora considera que el electrón se encuentra en el nivel 2 y cae energéticamente al nivel basal. Señala el signo de la energía EMITIDA.3. Determina la energía del nivel n = 3. Analiza y concluye si los espaciados entre niveles tienen el mismo valor, si aumentan o si se van haciendo cada vez más pequeños. Justifica tu respuesta.