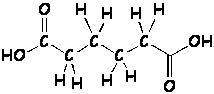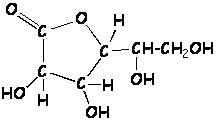1.5. Moléculas, iones y fórmulas químicas
Unidad 1: Introducción al estudio de la materia
Moléculas
Son agregados o grupos de por lo menos dos o más átomos, en una relación definida, que se mantienen unidos mediante fuerzas químicas denominadas “enlaces covalentes” (por compartición de electrones), se mueven y actúan juntas como si fuesen una sola identidad.
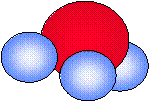
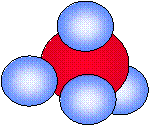
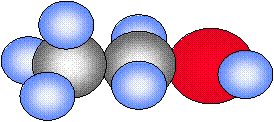
| Hidrógeno | Agua | Amoníaco | Metano | Etanol |
| H2 | H2O | NH3 | CH4 | CH3CH2OH |
 |
 |
 |
 |
Tipo de moléculas
Iones
Están formados por un átomo o un grupo de átomos, que tienen una carga neta positiva o negativa, en consecuencia pueden ser de dos tipos:
- Los cationes: se forman cuando el átomo neutro pierde uno o varios de sus electrones, en consecuencia son iones de carga neta positiva.
 |
átomo neutro:
11 protones 11 electrones |
 |
catión:
11 protones 10 electrones |
- Los aniones: se forman cuando el átomo neutro gana uno o más electrones, en consecuencia son iones de carga neta negativa.
 |
átomo neutro:
17 protones 17 electrones |
 |
anión:
17 protones 18 electrones |
El cloruro de sodio que consumimos con nuestros alimentos, es un compuesto iónico formado por un catión sodio, Na+, y un anión cloruro, Cl–:
| Ión | Monoatómicos: provienen de un sólo átomo | Poliatómicos: contienen más de un átomo |
|---|---|---|
| Cationes | Li+; Na+; K+; Mg2+; Ca2+; Ba2+; Al3+ | NH4+; PH4+ |
| Aniones | O2-; N3- | OH–; CN–; NO3–; CO32-; SO42-; Cr2O42- |
Fórmulas químicas
Nos indican qué elementos participan en la formación de una molécula o de un compuesto iónico y la relación que guardan entre sí los átomos que la conforman.
| Nombre del compuesto | Tipo de compuesto | Elementos participantes | Relación | Fórmula global | Contenido por mol de compuesto |
|---|---|---|---|---|---|
| ácido sulfúrico | molecular | hidrógeno, H
azufre, S oxígeno, O |
2 : 1 : 4 | H2SO4 |
2 moles de átomos de H 1 mol de átomos de S 4 moles de átomos de O |
| benceno | molecular | carbono, C
hidrógeno, H |
6 : 6 | C6H6 |
6 moles de átomos de C 6 moles de átomos de H |
| ácido nítrico | molecular | hidrógeno,H
nitrógeno, N oxígeno, O |
1 : 1: 3 | HNO3 |
1 mol de átomos de H 1 mol de átomos de N 3 moles de átomos de O |
| amoníaco | molecular | nitrógeno, N
hidrógeno, H |
1 : 3 | NH3 |
1 mol de átomos de N 3 moles de átomos de H |
| cloruro de calcio | iónico | ion calcio, Ca2+
iones cloruro, Cl– |
1 : 2 | CaCl2 |
1 mol de iones Ca2+ 2 moles de iones Cl– |
| óxido de magnesio | iónico | ion magnesio, Mg2+
ion oxígeno, O2- |
1 : 1 | MgO | 1 mol de iones Mg2+
1 mol de iones O2- |
| óxido de aluminio | iónico | iones aluminio, Al3+
iones oxígeno, O2- |
2 : 3 | Al2O3 |
2 moles de iones Al3+ 3 moles de iones O2- |
| óxido férrico (herrumbre) | iónico | iones fierro, Fe3+
iones oxígeno, O2- |
2 : 3 | Fe2O3 |
2 moles de iones Fe3+ 3 moles de iones O2- |
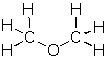
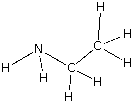
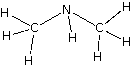
Muchas veces nos es más útil representar los compuestos químicos mediante las fórmulas estructurales, que nos muestran la forma cómo están enlazados los átomos dentro del compuesto, tal como se muestra a continuación:
Observemos el caso del etanol y el éter, vemos que ambas sustancias tienen los mismos elementos participantes y en las mismas proporciones; C : H : O en 2 : 6 : 1; lo mismo ocurre en el caso de la etilamina y la dimetilamina donde C : H : N es 2 : 7 : 1. Debemos tener en cuenta que en cada caso, ambas sustancias tienen distintas propiedades y comportamiento químico.
Fórmulas empírica y molecular
Las fórmulas que hemos visto, nos indican la cantidad de átomos de cada tipo que están presentes en la molécula en estudio, así como cuál es la relación existente entre ellos, éstas se denominan fórmulas moleculares.
Analicemos por ejemplo, el caso del amoníaco, NH3, donde podemos observar que la relación entre los átomos de N : H es de 1 : 3, que es la relación mínima posible entre ellos. Por otra parte, en el caso del ácido sulfúrico, H2SO4, vemos que la relación entre átomos de H : S : O es 2 : 1 : 4, que también es la mínima relación posible.
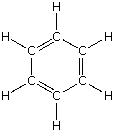
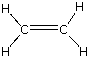
Fijémonos ahora en el benceno, C6H6, donde la relación que presenta entre los átomos C : H es 6 : 6 sin embargo podemos establecer que la relación mínima sería de 1 : 1. Veamos también el caso del acetileno, C2H2, cuya relación entre átomos C : H es de 2 : 2 pero su relación mínima es de 1 : 1.
En base a lo analizado podemos establecer que la fórmula empírica nos indica cuál es la relación mínima existente entre los átomos que están presentes en la molécula en estudio:
| Compuesto | Fórmula molecular | Fórmula empírica |
|---|---|---|
| benceno | C6H6 | CH |
| acetileno | C2H2 | CH |
| glucosa | C6H12O6 | CH2O |
| ácido acético | CH3COOH | CH2O |
 |
Problema 1.4 Podemos determinar fácilmente la masa de una molécula de cualquier sustancia, conociendo las masas atómicas de cada uno de los átomos que la conforman, por ejemplo, para el ácido acético: |
| 2 átomos de C ⇒ | 2 átomos C x 12 uma / átomo C = | 24 uma |
| 4 átomos de H ⇒ | 4 átomos H x 1 uma / átomo H = | 4 uma |
| 2 átomos de O ⇒ | 2 átomos O x 16 uma / átomo O = | 32 uma |
| masa de 1 molécula de CH3COOH | 60 uma | |
Como vimos anteriormente, la masa de un átomo se expresa en uma y la masa de un mol de átomos se expresa en gramos, análogamente, la masa de una molécula se expresa en uma y la masa de un mol de moléculas se expresa en gramos.
En consecuencia, podemos afirmar que la masa de un mol de moléculas de ácido acético (o simplemente un mol de ácido acético) es de 60 g/mol, que se le denomina, masa molar.
 |
Recuerda La masa de una partícula (átomo o molécula) se expresa en unidades de masa atómica, uma La masa de un mol de partículas (de átomos o de moléculas) se expresa en gramos, g |
Normalmente cuando se analiza una sustancia, se obtiene la composición porcentual de la misma, es decir el porcentaje en que están presentes cada uno de los elementos detectados. Con esta información se puede determinar cuál es la fórmula empírica de la sustancia en estudio y, conociendo la masa molar de dicha sustancia, es posible conocer cuál es la fórmula molecular de la misma, por ejemplo:
 |
Problema 1.5 El azúcar es una sustancia capaz de modificar las propiedades del concreto, así en dosificaciones mayores a 0,25 % del peso del cemento acelera el proceso de fraguado y menores a 0,25 % del peso del cemento actúa como retardador del proceso. El azúcar que consumimos es la sacarosa, cuya composición química es de 42,11 % de carbono, C; 6,43 % de hidrógeno, H y 51,46 % de oxígeno, O. Determinemos la fórmula empírica de la sacarosa: |
Lo primero que debemos hacer es fijar una determinada masa de sacarosa para poder trabajar, dado que la composición es porcentual, lo más sencillo es considerar 100 g de sacarosa, por lo tanto, tendremos 42,11 g de C; 6,43 g de H y 51,46 g de O y con esta información determinamos cuántas moles de cada elemento están presentes:
Para determinar la fórmula empírica necesitamos conocer cuál es la relación mínima entre los átomos participantes, recuerda que deben ser valores enteros, para ello hallamos el mínimo común divisor (dividimos entre el menor de los valores):
C : 3,51 ÷ 3,22 = 1,090 este valor no podemos aproximarlo a 1,0
H : 6,43 ÷ 3,22 = 1,997 este valor podría aproximarse a 2,0
O : 3,22 ÷ 3,22 = 1,000
Dado que buscamos valores enteros, buscamos el múltiplo menor que cumpla con el requisito de ser la mínima relación, en nuestro caso se trata del 11, por lo tanto obtenemos:
C : 1,090 x 11 = 11,99 ⇒ 12,00
H : 1,997 x 11 = 21,97 ⇒ 22,00
O : 1,000 x 11 = 11,00
Por lo tanto, la relación de átomos C : H : O es 12 : 22 : 11 y la fórmula empírica, FE, de la sacarosa será C12H22O11
Para poder determinar la fórmula molecular, FM, de la sustancia en estudio, es necesario conocer la masa molar, para saber cuántas veces contiene a la masa de la fórmula empírica. En el caso de la sacarosa, se sabe que su masa molar es de 342 g/mol, por lo que debemos determinar cuál es la masa de la fórmula empírica:
masa FE = 12 mol C(12 g C/mol C) + 22 mol H(1 g H/mol H) + 11 mol O(16 g O/mol O)
masa FE = 342 g
En consecuencia, encontramos que en este caso : FM = FE