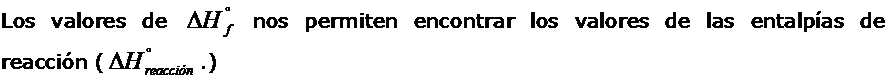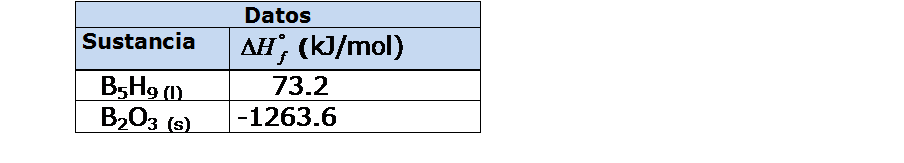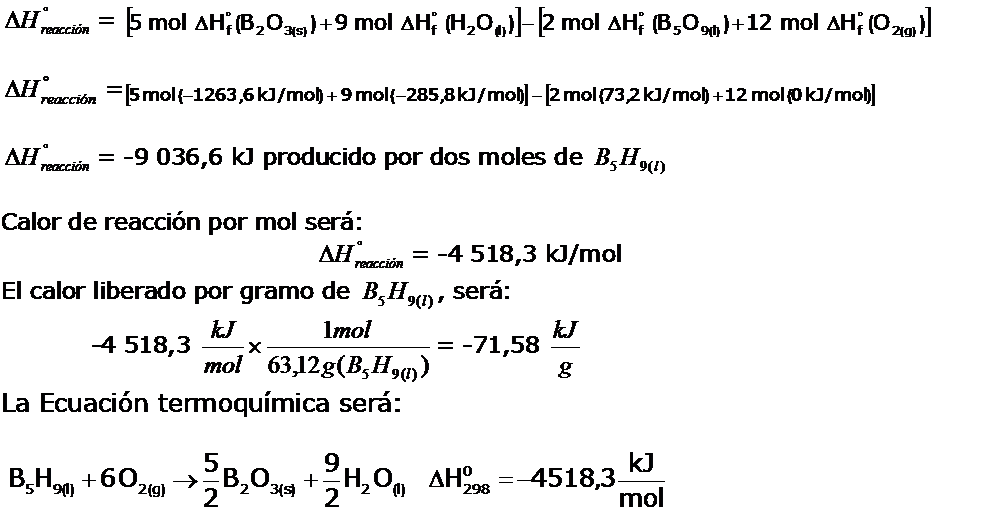1.4.1.- Cálculo de calor de reacción: Entalpías de Formación.
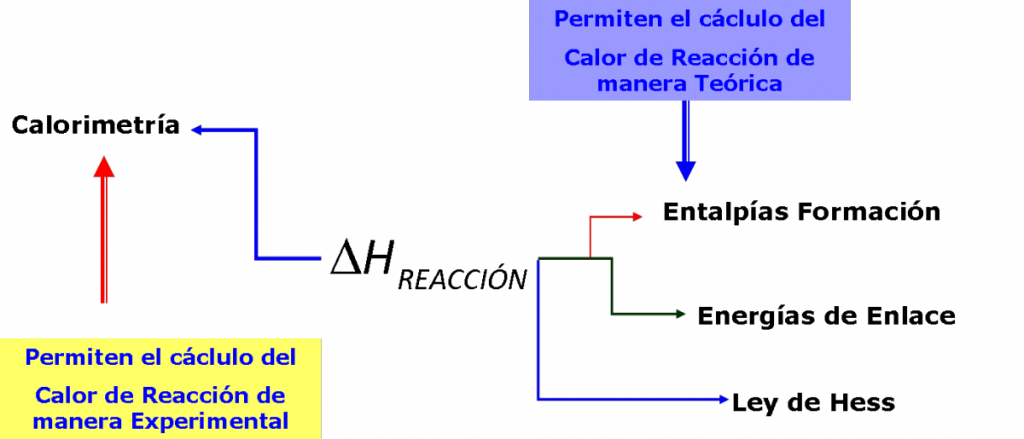
El cálculo de calor de reacción, propiedad extensiva. Antes de inciar una reacción química es importante conocer si la reacción será exotermica o endotérmica, ademas de conocer la magnitud del calor liberado o el calor absorbido en ella. Sin este valor, no se podá iniciar ningún proceso químico a escala industrial.
Entre muchas cosas, debemos conocer la cantdidad de energía que debemos suministar para que la reacción se efectúe, o conocer la cantidad de calor que generará la reacción, para poder seleccionar el material de los recipientes en donde se va efectuar la reacción, debemos evaluar si estos resistieran el calor liberado.
El calor de reacción puede ser hallado varias formas:
- de manera teoríca
- de manera experimental
Tal como lo muestra el diagrama siguiente:
Calculo del Calor de Reacción por Entalpías de Formación
Definición de Entalpía de Formación
Primero debemos definir la reacción química de Formación: ésta es la reacción que produce un mol de la sustancia a partir de sus elementos en su forma mas estable.
Por ejemplo, la reacción de formación del propano, C3H8 (g) se denota de la manera siguiente:
3 C(grafito) + 4H2(g) → C3H8(g)
La entalpía de formación será el calor que se produce o que se necesita para formar un mol de un compuesto a partir de sus elementos en su forma más estable.
La entalpía estándar de formación, se denota de la manera siguiente:
![]() Nos indica el calor de formación de los compuestos para condiciones estándares.
Nos indica el calor de formación de los compuestos para condiciones estándares.
Por convención los valores de la Entalpías estándar de formación a 298 K, para elementos en su forma más estable, se les asigna el valor de cero.
En la tabla siguiente, se muestran entalpías estándares de formación para diferentes sustancias. Observa los valores de estas entalpías para el carbono en sus diferentes estados alotrópicos (grafito, diamante) se puede comprobar que el grafito es la forma elemental más estable del carbono, tambíen analiza los valores del O (g); O2(g) y O3(g).
a A + b B → c C + d D
Se puede calcular el Calor de Reacción a partir de las entalpías de formación, de las sustancias que conforman los productos y las que conforman los reactantes.
Tengan en cuenta que la variación de cualquier variable está determinada por la diferencia entre la posición final (productos) y la posición inicial (reactantes).
Por lo tanto, se puede calcular la Entalpia de reacción estándar de la reacción, como la diferencia entre la sumatoria de las entalpías de formación de productos, menos la sumatoria de las entalpías de formación de los reactantes.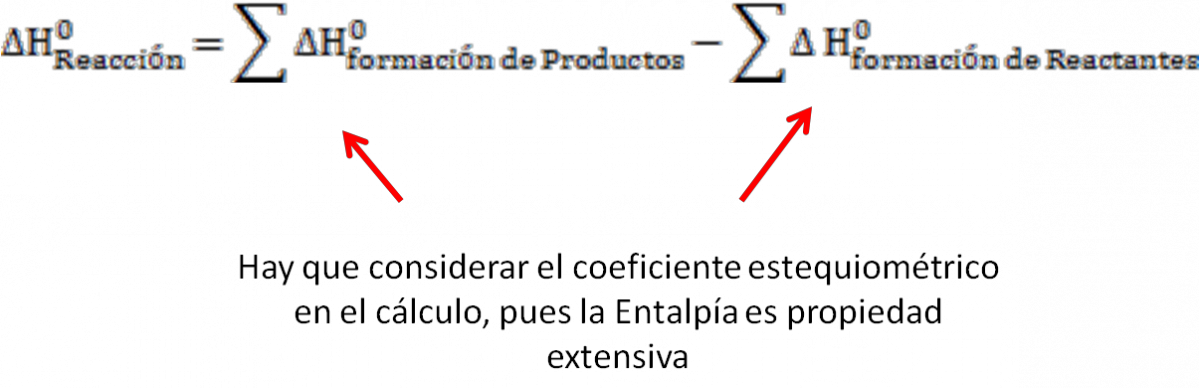
El calculo de la Entalpía de Formación estándar para la reacción genérica planteada, será:
![]() Tengan en cuenta que cada valor de entalpía de formación de las sustancias, ya sean reactantes o productos está multiplicada por el indice estequiométrico presente en la reacción. Por lo que primero deberán balancear la reacción quimica.
Tengan en cuenta que cada valor de entalpía de formación de las sustancias, ya sean reactantes o productos está multiplicada por el indice estequiométrico presente en la reacción. Por lo que primero deberán balancear la reacción quimica.
 |
En el enlace siguiente tiene una tabla con valores de calor de reacción. |