1.4.- Termoquímica
El cambio de energía que acompaña a una reacción química, se le conoce como entalpía de reacción o calor de reacción.
Recuerden las reacciones químicas constituyen los sistemas.
Imágenes como la que se muestran a continuación, nos dan clara idea que hay reacciones que liberan calor al entorno.
 http://es.wikipedia.org/wiki/Energía_térmica
http://es.wikipedia.org/wiki/Energía_térmica
Cuando la reacción química (sistema), libera calor al entorno entonces se dice que se trata de una reacción exotérmica.
Si embargo tambien conocemos otros tipos de reacciones que para que se lleven a cabo es necesario que el entorno le sumistre el calor necesario, un ejemplo simple está representado por la imagen siguiente:
 http://www.tadega.net/Fotos/index.php/SPC/verbos/cocinar
http://www.tadega.net/Fotos/index.php/SPC/verbos/cocinar
Si el sistema (reacción química), requiere que el entorno o los alrededores le entregue calor, para que se lleve a cabo la reacción, se dice que se trata de una reacción endotérmica.
El calor de reacción, puede encontrarse de varias formas, ya sea de manera experimental (la más exacta) o por conocimiento de los cambios de energía interna o entalpía asociados a otras reacciones, como veremos a través del desarrollo de este capítulo.
Ecuación termoquímica
Es la representación de un proceso termodinámico que puede ser un cambio físico o químico.
La ecuación termoquímica debe contener:
• Las fórmulas de las sustancias involucradas.
• Los coeficientes estequiométricos.
• El estado físico de cada sustancia (sólido, líquido, gaseoso, acuoso).
• La temperatura y la presión.
• El calor involucrado en el proceso ![]() La variación de Energía interna o la variación de la Entalpía, asociada a una reacción termoquímica debe señalarse de la manera siguiente:
La variación de Energía interna o la variación de la Entalpía, asociada a una reacción termoquímica debe señalarse de la manera siguiente:
 En la tabla que se da a continuación, se establecen las condiciones del estado estándar para los diferentes estados de la materia.
En la tabla que se da a continuación, se establecen las condiciones del estado estándar para los diferentes estados de la materia.
En el primer ejemplo se ha escrito la ecuación termoquímica, teneidneo en cuenta el estado de la materia, temperatura y presion de cada uno de los reacitivos y productos.
![]() En este segundo ejemplo, es la misma ecuación termoquimica, paro más simplificada, solo se incluye el estado de la materia para reactivos y productos. Esta es la notación más empleada.
En este segundo ejemplo, es la misma ecuación termoquimica, paro más simplificada, solo se incluye el estado de la materia para reactivos y productos. Esta es la notación más empleada.
![]() Recuerden si no tiene los estado de agregación de reactantes y productos y el dato de Entalpia de reacción, no estarán escribiendo una ecuación termoquímica.
Recuerden si no tiene los estado de agregación de reactantes y productos y el dato de Entalpia de reacción, no estarán escribiendo una ecuación termoquímica.
Analice las siguientes consideraciones:
 Variación de la entalpía en un cambio de fase.
Variación de la entalpía en un cambio de fase.
Si un trozo de hielo, H2O(s), lo colocamos sobre una mesa, sabemos que al poco tiempo, tendremos una cantidad de H2O líquida sobre ésta. Lo que ha ocurrido es un cambio de fase el H2O(s) a pasado a H2O (l). ¿Cuál es la razón del cambio de estado?, conocemos la respuesta, la temperatura ambiente ha “derretido” el hielo.
Termodinámicamente, diremos que el entorno le entregó calor al sistema. El cambio de estado del H20 de sólido a líqudio será un proceso endotérmico. Mientras que, si queremos pasar de H2O líquida a H2O sólida, el sistema tendrá que perder calor, para que se efectúe el cambio de fase. El proceso será exotérmico.
Podemos concluir que los cambios de fase de una sustancia consumen o liberan calor según sea el sentido del cambio.
En procesos reversibles: si se liberan 44 kJ cuando un mol de vapor de agua se condensa, se requerirán 44 kJ de energía para que se evapore 1 mol de agua líquida. A manera de ejercicio, escribe las ecuaciones termodinámicas para los cambios mencionados.
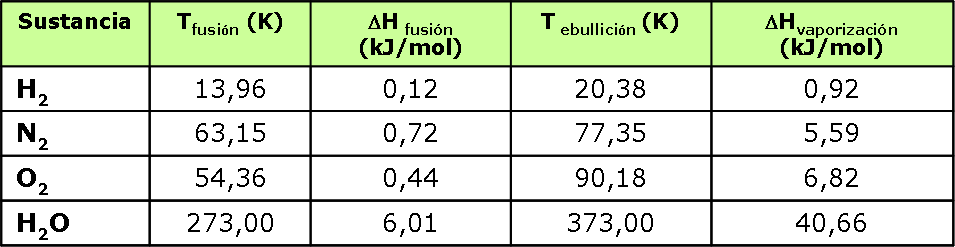
La siguiente tabla nos muestra valores de Entalpías de fusión y de vaporización de algunas sustancias.