1.3.3.- Primera Ley de la Termodinámica: Procesos Isocóricos y Procesos Adiabáticos.
Proceso Isocórico
En un proceso isoccórico, el volumen permance constante.
Si observamos el diagrama siguiente:
 En un proceso isocórico la variación del volumen sería nula, esto quiere decir que el sistema no ejercería ni recibiría trabajo.
En un proceso isocórico la variación del volumen sería nula, esto quiere decir que el sistema no ejercería ni recibiría trabajo.
Si la variación del volumen es igual a cero, el trabajo también será igual a cero. ![]() Teniendo en cuenta la primera Ley de la Termodinámica, la variación de la energía interna será igual al calor.
Teniendo en cuenta la primera Ley de la Termodinámica, la variación de la energía interna será igual al calor.
![]() Observen que el calor se denota como ( qV ), lo que nos indica que el calor a volumen constante es igual a la variación de energía interna.
Observen que el calor se denota como ( qV ), lo que nos indica que el calor a volumen constante es igual a la variación de energía interna.
Recordemos que el calor a presión constante es igual a la Variación de la Entalpía.
Si el sistema son gases ideales podemos establecer la siguiente relación: ![]() El gráfico PV de un isotérmico será:
El gráfico PV de un isotérmico será:
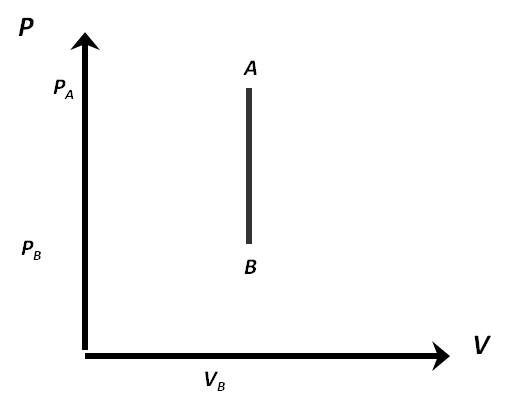 Donde se observa que no hay trabajo, recuerden que el trabajo es el área bajo la curva.
Donde se observa que no hay trabajo, recuerden que el trabajo es el área bajo la curva.
Proceso Adiabático
En proceso adiabático, el sistema es un sistema aislado, el sistema no recibe ni entrega calor al entorno (q = 0).
Un ejemplo de sistemas adiabáticos son los termos, se guarda por ejemplo agua caliente y está se mantiene de esta manera pues no deja salir el calor al entorno.
Por lo tanto, al aplicar la Primera Ley de la Termodinámica, la variación de la energía interna dependerá únicamente del trabajo realizado o recibido por el sistema. ![]()
![]() Analicemos lo siguiente, para un proceso Adiabático:
Analicemos lo siguiente, para un proceso Adiabático:
- Si el volumen de los gases se contrae, entonces la variación del volumen es negativa, por lo tanto el w tendrá signo positivo. El entorno ejerce trabajo sobre el sistema.
- Si el volumen de los gases se expande, entonces la variación del volumen es positiva, por lo tanto el w tendrásigno negativo. El entorno recibe trabajo del sistema.
En la sección Ejercicios Propuestos Química 2, en Unidad 1 encontrará una hoja de ejercicios propuestos “Ejercicios de repaso #1” les sugerimos que los realicen.
