1.3.1.- Calor Específico y Capacidad Calorífica
En un día de verano, el sol calienta la arena de las playas y todo lo que sobre ella se encuentra. Suponga que sobre la arena hay una toalla, una botella de plástico y un vaso de metal, los tres objetos están expuestos al calor del sol la misma cantidad de tiempo.
Basándote en tu experiencia, responde:
- Cuando tocas cada uno, de los tres objetos, ¿estarán estos objetos igual de calientes?
- ¿Cuál de los tres objetos estará más caliente?
Del análisis de la situación anterior, podemos concluir que cada objeto habrá absorbido una cantidad distinta de calor. En otras palabras podemos decir que cada material tiene una capacidad de almacenar calor de manera diferente, esta capacidad depende de la naturaleza y composición del mismo. Esta situación que entendemos y que nos resulta familiar como experiencia de vida, nos va a llevar a la definición de Capacidad Calorífica.
La capacidad calorífica se puede expresar como la cantidad de calor requerida para elevar en 1ºC, la temperatura de una determinada cantidad de sustancia. Cuanto mayor sea la capacidad calorífica de una sustancia, mayor será la cantidad de calor entregada a ella para subir su temperatura. Por ejemplo, no es lo mismo calentar el agua de un vaso que el agua de toda una piscina: requerimos mayor calor para calentar el agua de toda una piscina puesto que su capacidad calorífica es mucho mayor.
La capacidad calorífica (C) (propiedad extensiva), se expresa como “calor” sobre “grados centígrados” y, por tanto, tiene las siguientes unidades:
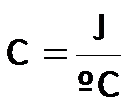 El calor específico (c) (propiedad intensiva) tiene las siguientes unidades:
El calor específico (c) (propiedad intensiva) tiene las siguientes unidades: 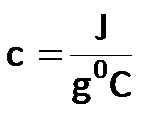 El calor específico es una propiedad intensiva, no depende de la materia, y es un valor fijo para cada sustancia. Así, el agua tiene un valor fijo de calor específico, el cual debemos entenderlo como la cantidad de calor que puede absorber una sustancia: cuanto mayor sea el calor específico, mayor cantidad de calor podrá absorber esa sustancia sin calentarse significativamente.
El calor específico es una propiedad intensiva, no depende de la materia, y es un valor fijo para cada sustancia. Así, el agua tiene un valor fijo de calor específico, el cual debemos entenderlo como la cantidad de calor que puede absorber una sustancia: cuanto mayor sea el calor específico, mayor cantidad de calor podrá absorber esa sustancia sin calentarse significativamente.
Según tu experiencia, de los 3 materiales anteriores (toalla, botella de plástico y lata de metal):
- ¿Cuál tendrá mayor calor específico?
- ¿Cuál tendrá menor calor específico?
La relación entre la capacidad calorífica y el calor específico está dado por:
C = m c
Ejemplo
El calor específico de agua es : ![]() Mientras que la capacidad calorífica de 60 g de agua será:
Mientras que la capacidad calorífica de 60 g de agua será: ![]() La capacidad calorífica molar, se expresa de la siguiente manera:
La capacidad calorífica molar, se expresa de la siguiente manera:
Tenga en cuenta que la C de capacidad Calorífica está en mayúsculas 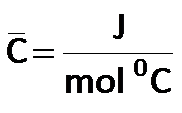 Cuando se añade o disminuye calor a un sistema, se produce una variación de temperatura en el sistema.
Cuando se añade o disminuye calor a un sistema, se produce una variación de temperatura en el sistema.  Donde:
Donde:
m = masa, gramos
c = calor específico, J/g °C
 |
Ejercicio 1.6
|
Capacidad Calorífíca de los gases
Para los gases ideales, si se determina la capacidad calorífica molar para un mismo gas a:
- volumen constante se denomina,CV
- presión constante se denomina, CP
La relación existente entre ellas está determinada por la expresión siguiente: ![]() Donde:
Donde:
- R es la constante de los gases ideales expresada en unidades de energía: .
R = 8,314 J/mol-K R = 1,989 cal/mol-K
La capacidad calorífica de los gases ideales varía, si se trata de gases monoatómicos, diatómicos y triatómicos.
En la tabla siguiente se muestran los valores de capacidad calorífica a volumen constante ( CV ) y a presión constante ( CP ) para gases ideales monoatómicos, diatómicos y triatómicos.
Si el sistema involucra a los gases ideales podemos expresar el calor a presión constante (qP ), como:
![]() Recuerden que el calor a presión contante, se conoce como Entalpía (H)
Recuerden que el calor a presión contante, se conoce como Entalpía (H)
